Travailler autrement
Histoires des sciences
Un modèle millénaire
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
A. Premières représentations
Démocrite (~460-370 av. J.-C.) est un philosophe grec qui propose une représentation du monde dans laquelle la matière est faite de très petites particules qu'il nomme atomes. Cette théorie philosophique sera oubliée au profit de la théorie des quatre éléments durant deux millénaires.
John Dalton (1766-1844), après dix ans passés à étudier les gaz, publie ses conclusions en 1808 : selon lui, il ne fait pas de doute que la matière est constituée d'atomes, pour lesquels il propose une première classification.
John Dalton (1766-1844), après dix ans passés à étudier les gaz, publie ses conclusions en 1808 : selon lui, il ne fait pas de doute que la matière est constituée d'atomes, pour lesquels il propose une première classification.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Dalton


Dalton
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
B. Découvertes des particules composant l'atome
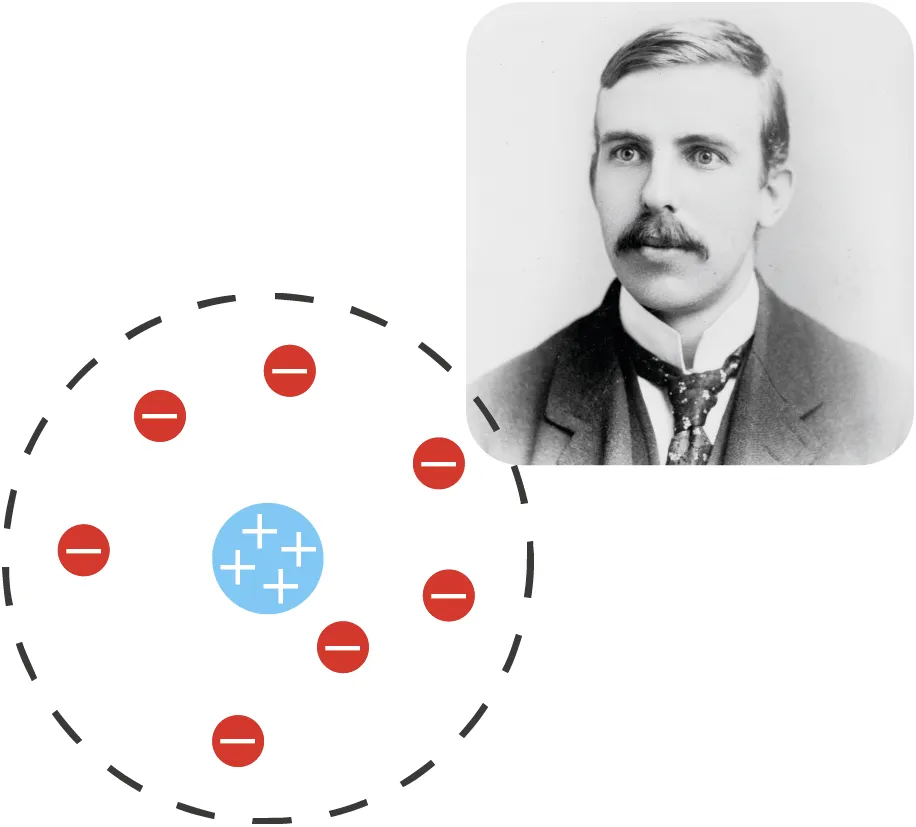
Joseph J. Thomson (1856-1940) montre l'existence de particules négatives (les électrons) dans l'atome, grâce à l'étude des rayons cathodiques. Il propose une nouvelle représentation de l'atome, le plum-pudding (gâteau aux prunes).
Ernest Rutherford (1871-1937), à travers une célèbre expérience, découvre que l'atome contient un noyau très dense et très petit. Il propose un modèle planétaire dans lequel les électrons orbitent autour du noyau, incompatible cependant avec les lois de l'électromagnétique.
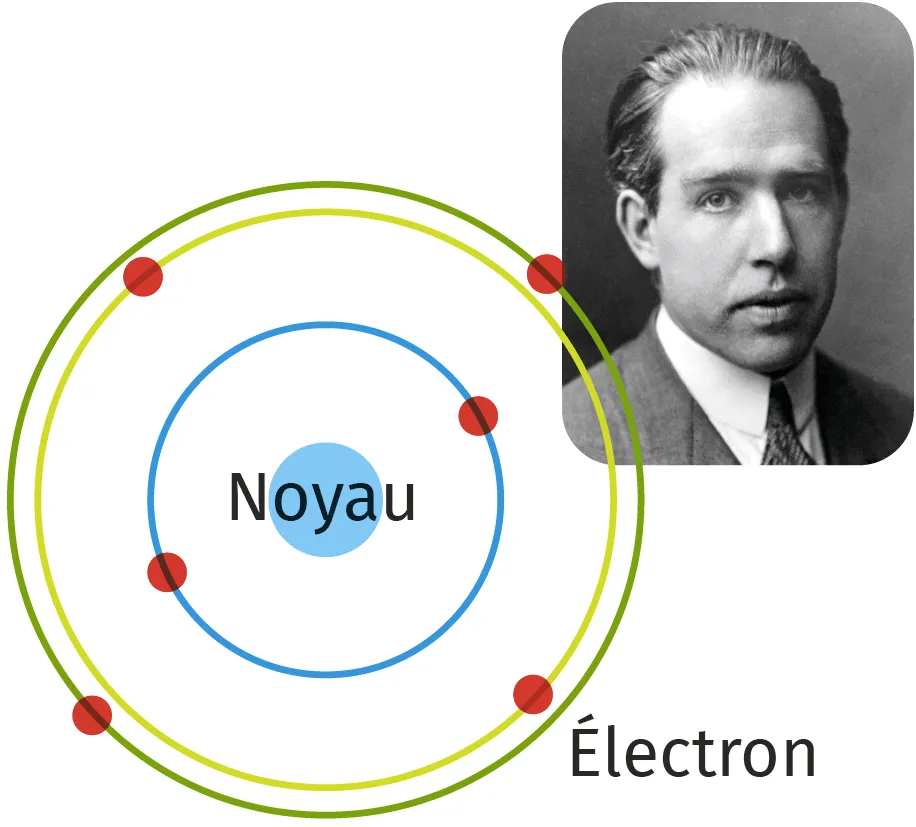
Niels Bohr (1885-1962) améliore le modèle de Rutherford en proposant que les électrons ne puissent occuper que des orbites précises, obéissant à des lois spécifiques de remplissage. Son modèle rencontre un grand succès car il permet d'expliquer plusieurs observations expérimentales.
Ernest Rutherford (1871-1937), à travers une célèbre expérience, découvre que l'atome contient un noyau très dense et très petit. Il propose un modèle planétaire dans lequel les électrons orbitent autour du noyau, incompatible cependant avec les lois de l'électromagnétique.
Niels Bohr (1885-1962) améliore le modèle de Rutherford en proposant que les électrons ne puissent occuper que des orbites précises, obéissant à des lois spécifiques de remplissage. Son modèle rencontre un grand succès car il permet d'expliquer plusieurs observations expérimentales.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Thomson


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Bohr

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Rutherford

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
C. Questionnement autour de la place des électrons
La physique des années 1920 est révolutionnaire. On découvre que la matière a une double nature : elle se comporte soit comme une onde, soit comme une particule, suivant le contexte expérimental ! C'est en particulier le cas des électrons, qui se comportent comme des ondes dans un atome.
Erwin Schrödinger (1887-1961) contribuera à de grandes avancées dans le domaine de l'atomistique. Il montre qu'au sein d'un atome, l'idée de trajectoire de l'électron n'a pas de sens. Dans son modèle, les orbitales atomiques (voir ci-dessous) sont donc des zones où la probabilité de présence des électrons est grande, sans que l'on puisse définir précisément leur trajectoire. Ce modèle, actuellement utilisé, permet de comprendre la nature des liaisons moléculaires et d'en expliquer la géométrie.
Erwin Schrödinger (1887-1961) contribuera à de grandes avancées dans le domaine de l'atomistique. Il montre qu'au sein d'un atome, l'idée de trajectoire de l'électron n'a pas de sens. Dans son modèle, les orbitales atomiques (voir ci-dessous) sont donc des zones où la probabilité de présence des électrons est grande, sans que l'on puisse définir précisément leur trajectoire. Ce modèle, actuellement utilisé, permet de comprendre la nature des liaisons moléculaires et d'en expliquer la géométrie.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Schrödinger


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.

Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

