Chapitre 8
Exercices
Pour s'entraîner
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21Arbre de Diane
✔ MOD : Modéliser une transformation
On plonge un morceau de cuivre solide dans un bécher contenant une solution incolore contenant des ions argent notés \text{Ag}^+. Quelques instants après, on ajoute une solution d'hydroxyde de sodium dans la solution finale, et on constate l'apparition d'un précipité bleu.
On plonge un morceau de cuivre solide dans un bécher contenant une solution incolore contenant des ions argent notés \text{Ag}^+. Quelques instants après, on ajoute une solution d'hydroxyde de sodium dans la solution finale, et on constate l'apparition d'un précipité bleu.


1.
D'après l'observation des photos et l'énoncé, analyser les produits formés lors de cette réaction.
2.
Écrire l'équation de la réaction chimique ayant eu lieu dans le bécher.
Rappel
Les ions cuivre notés \text{Cu}^{2+} (II) forment un précipité bleu lorsqu'ils sont en contact d'une solution d'hydroxyde de sodium.
Étymologie
Le nom donné à cet édifice chimique provient de l'alchimie. En effet, les personnages de la mythologie romaine étaient associés aux métaux. Diane était le nom associé à l'argent. Ainsi, cette végétation métallique d'argent a pris le nom d'arbre de Diane.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22
Le bicarbonate en QCM
✔ MOD : Modéliser une transformationLe bicarbonate de sodium peut faire office de levure pour les pâtisseries. En effet, en chauffant du bicarbonate de sodium, on obtient de l'eau, du dioxyde de carbone et du carbonate de sodium de formule \text{Na}_2\text{CO}_3(s).
1.
Sachant que les nombres stœchiométriques sont tous égaux à un sauf celui du réactif, la formule du bicarbonate de sodium est :
2.
Quel produit permet de faire gonfler une préparation culinaire ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23Eau de chaux
✔ MOD : Modéliser une transformation
Fréquemment utilisée en Sciences de la vie et de la Terre, l'eau de chaux permet de vérifier la présence de dioxyde de carbone dans une solution.
Elle est préparée à partir de calcaire de formule \text{CaCO}_{3} qui est chauffé pour se décomposer en dioxyde de carbone et en oxyde de calcium de formule \text{CaO}. Ce dernier, aussi appelé chaux vive, est hydraté pour produire de la chaux éteinte de formule \text{Ca}(\text{OH})_{2}. On obtient alors de l'eau de chaux en diluant ce produit légèrement.
Fréquemment utilisée en Sciences de la vie et de la Terre, l'eau de chaux permet de vérifier la présence de dioxyde de carbone dans une solution.
Elle est préparée à partir de calcaire de formule \text{CaCO}_{3} qui est chauffé pour se décomposer en dioxyde de carbone et en oxyde de calcium de formule \text{CaO}. Ce dernier, aussi appelé chaux vive, est hydraté pour produire de la chaux éteinte de formule \text{Ca}(\text{OH})_{2}. On obtient alors de l'eau de chaux en diluant ce produit légèrement.
1.
Écrire les deux équations de réaction permettant de transformer le calcaire en chaux éteinte.
Si on souffle à l'aide d'une paille dans une solution d'eau de chaux, elle va se troubler : un précipité s'est formé par réaction avec le dioxyde de carbone expiré.
2. Sachant que cette réaction produit aussi de l'eau, et que tous les nombres stœchiométriques sont égaux à 1, trouver la formule du précipité formé.
Si on souffle à l'aide d'une paille dans une solution d'eau de chaux, elle va se troubler : un précipité s'est formé par réaction avec le dioxyde de carbone expiré.
2. Sachant que cette réaction produit aussi de l'eau, et que tous les nombres stœchiométriques sont égaux à 1, trouver la formule du précipité formé.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24La combustion de l'éthanol
✔ MATH : Utiliser le calcul numérique
On imbibe un morceau de tissu avec de l'éthanol de formule \text{C}_2\text{H}_6\text{O}. Après avoir enflammé le tissu dans un flacon, on constate qu'il y a de la vapeur d'eau sur les parois du flacon, et l'eau de chaux que l'on insère dans le flacon se trouble. Le tissu est seulement un support pour réaliser la réaction, il n'y participe pas.
1. Toutes les espèces chimiques présentes dans l'air participent-elles à la combustion ?
2. Décrire le système à l'état initial et à l'état final.
3. En déduire l'équation de la réaction ayant eu lieu.
4. Les réactifs ont une masse de 100 g à l'instant initial et 38 mL d'eau se sont formés. Quelle masse du deuxième produit a été formée ?
1. Toutes les espèces chimiques présentes dans l'air participent-elles à la combustion ?
2. Décrire le système à l'état initial et à l'état final.
3. En déduire l'équation de la réaction ayant eu lieu.
4. Les réactifs ont une masse de 100 g à l'instant initial et 38 mL d'eau se sont formés. Quelle masse du deuxième produit a été formée ?
Données
Détails du barème
TOTAL /6,5 pts
1 pts
1.
Connaître la composition de l'air et les réactifs utiles à la combustion.1 + 1 pt
2.
Lister les réactifs et les produits.1 + 0,5 pt
3.
Écrire correctement l'équation de réaction et les nombres stœchiométriques.1 pt
4.
Utiliser la conservation de la masse.1 pt
4.
Utiliser la masse volumique pour trouver la masse d'eau formée.Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
25
Décomposition de l'eau oxygénée
✔ MOD : Utiliser le modèle de l'énergie
L'eau oxygénée ou peroxyde d'hydrogène est très utilisée pour ses propriétés oxydantes. Agent de blanchiment ou antiseptique, le peroxyde d'hydrogène \text{H}_2\text{O}_2 peut se décomposer en deux produits très courants selon une réaction vive mais non toxique produisant de la chaleur. La poussière peut entraîner cette vive dismutation. Ainsi, le peroxyde d'hydrogène est souvent vendue sous l'appellation eau oxygénée stabilisée car des agents permettant d'éviter la dégradation de la molécule ont été ajoutés.
L'eau oxygénée ou peroxyde d'hydrogène est très utilisée pour ses propriétés oxydantes. Agent de blanchiment ou antiseptique, le peroxyde d'hydrogène \text{H}_2\text{O}_2 peut se décomposer en deux produits très courants selon une réaction vive mais non toxique produisant de la chaleur. La poussière peut entraîner cette vive dismutation. Ainsi, le peroxyde d'hydrogène est souvent vendue sous l'appellation eau oxygénée stabilisée car des agents permettant d'éviter la dégradation de la molécule ont été ajoutés.
1.
D'après le nom commercial du peroxyde d'hydrogène, quels sont les deux produits formés par décomposition de cette molécule ?
2. Écrire l'équation de la réaction, appelée réaction de dismutation.
3. Comment peut-on qualifier cette transformation d'un point de vue énergétique ?
2. Écrire l'équation de la réaction, appelée réaction de dismutation.
3. Comment peut-on qualifier cette transformation d'un point de vue énergétique ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
26Éthylotest
✔ MOD : Modéliser une transformation




La conduite sous l'emprise de l'alcool est dangereuse car elle modifie la perception et l'attention du conducteur. L'éthylotest est utilisé par les forces de l'ordre pour vérifier le taux d'alcool dans le sang.
Un solide orange contenant des ions dichromate \text{Cr}_2\text{O}^{2-}_7 acidifiés par des ions \text{H}^+ est placé dans la barrette. Si la personne a absorbé de l'alcool, de l'éthanol \text{C}_2\text{H}_6\text{O} passe dans la barrette quand elle souffle dedans. Cela produit des ions chrome (III) \text{Cr}^{3+} de couleur verte, ainsi que de l'eau et de l'acide acétique \text{C}_2\text{H}_4\text{O}_2. Toutes les espèces étant piégées dans un gel de silice, on ne tient pas compte des états physiques pour l'écriture de l'équation de la réaction.
Un solide orange contenant des ions dichromate \text{Cr}_2\text{O}^{2-}_7 acidifiés par des ions \text{H}^+ est placé dans la barrette. Si la personne a absorbé de l'alcool, de l'éthanol \text{C}_2\text{H}_6\text{O} passe dans la barrette quand elle souffle dedans. Cela produit des ions chrome (III) \text{Cr}^{3+} de couleur verte, ainsi que de l'eau et de l'acide acétique \text{C}_2\text{H}_4\text{O}_2. Toutes les espèces étant piégées dans un gel de silice, on ne tient pas compte des états physiques pour l'écriture de l'équation de la réaction.
1.
Compléter l'équation de la réaction ayant lieu dans la barrette lorsque la personne qui a consommé de l'alcool souffle dans le ballon. Penser à la conservation des éléments mais aussi à celle de la charge.
2. L'éthanol soufflé par la personne doit-il être le réactif limitant ou le réactif en excès de la transformation ?
\text{3\:C}_2\text{H}_6\text{O} + \text{2\:Cr}_2\text{O}^{2-}_{7} + \text{H}^+ \rightarrow \text{3\:C}_2\text{H}_4\text{O}_2 + \text{Cr}^{3+}+ \text{H}_2\text{O}
2. L'éthanol soufflé par la personne doit-il être le réactif limitant ou le réactif en excès de la transformation ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
27Le fer est attaqué !
✔ MOD : Modéliser une transformation chimique
Le fer sous forme métallique ne résiste pas à l'attaque des acides s'il n'est pas au préalable recouvert d'une couche de protection.


Train rouillé, Salar d'Uyuni (Bolivie).
Le fer sous forme métallique ne résiste pas à l'attaque des acides s'il n'est pas au préalable recouvert d'une couche de protection.


Train rouillé, Salar d'Uyuni (Bolivie).
L'acide chlorhydrique de formule (\text{H}^+ ; \text{Cl}^-) est ajouté sur du fer solide \text{Fe.} Il se produit un dégagement gazeux ainsi que des ions fer (II) \text{Fe}^{2+}. Les ions chlorure \text{Cl}^- sont toujours présents en solution à la fin de la réaction.
1. Identifier le gaz formé.
2. Proposer un protocole pour l'identifier.
3. Écrire l'équation de la réaction chimique ayant lieu.
4. Les ions chlorure jouent-ils un rôle dans cette transformation chimique ? Quel nom leur donne-t-on ?
1. Identifier le gaz formé.
2. Proposer un protocole pour l'identifier.
3. Écrire l'équation de la réaction chimique ayant lieu.
4. Les ions chlorure jouent-ils un rôle dans cette transformation chimique ? Quel nom leur donne-t-on ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
28Copie d'élève à commenter
Proposer une justification pour chaque erreur relevée par le correcteur.
L'eau de Javel, produit d'entretien bien connu, est une solution d'hypochlorite de sodium.
L'hypochlorite de sodium \text{NaClO} est le produit de la réaction réalisée entre le dichlore \text{Cl}_2 gazeux et une solution aqueuse d'hydroxyde de sodium \text{NaOH.} Deux sous-produits sont également formés lors de cette synthèse : de l'eau \text{H}_2\text{O} et du chlorure de sodium formé en solution \text{NaCl.}
L'hypochlorite de sodium \text{NaClO} est le produit de la réaction réalisée entre le dichlore \text{Cl}_2 gazeux et une solution aqueuse d'hydroxyde de sodium \text{NaOH.} Deux sous-produits sont également formés lors de cette synthèse : de l'eau \text{H}_2\text{O} et du chlorure de sodium formé en solution \text{NaCl.}
1.
L'équation de réaction de la synthèse de l'hypochlorite de sodium est :
\text{Cl}_2 + \text{NaOH} \rightarrow \text{NaCl} + \text{NaClO} + \text{H}_2\text{O} Incomplet !
2. Si on veut optimiser la synthèse, il faut se placer dans les conditions stœchiométriques et donc faire en sorte qu'il y aitautant de dichlore qui réagisse avec de l'hydroxyde de sodium.
3. Aucun changement de température n'est observé pendant la synthèse donc cette transformation estendothermique.
\text{Cl}_2 + \text{NaOH} \rightarrow \text{NaCl} + \text{NaClO} + \text{H}_2\text{O} Incomplet !
2. Si on veut optimiser la synthèse, il faut se placer dans les conditions stœchiométriques et donc faire en sorte qu'il y ait
3. Aucun changement de température n'est observé pendant la synthèse donc cette transformation est
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
29Cycle du cuivre
✔ ANA : Faire le lien entre un modèle microscopique et des
observations macroscopiques
Le cuivre métallique est présent à l'état natif dans la croûte terrestre. Reconnaissable par sa couleur brique
au naturel, il est beaucoup utilisé en bijouterie. Au laboratoire, il est possible de montrer la conservation de cet élément chimique lors d'une série de réactions chimiques successives.

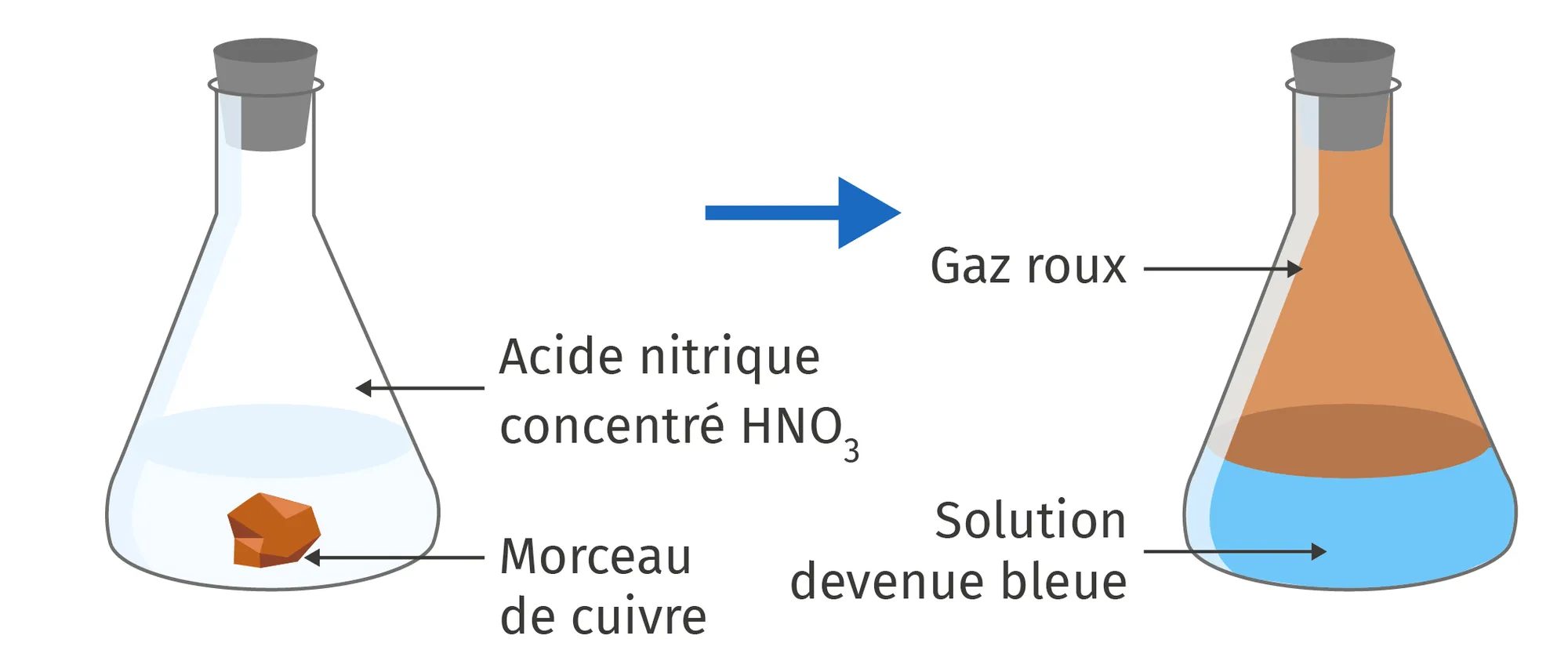
1. Remettre les différentes étapes expliquées ci-dessous (doc. 1) dans le bon ordre pour qu'à partir du cuivre métal, on passe par quatre réactions successives pour obtenir à nouveau du cuivre métal.
Doc. 1
Étapes de la réaction
a. Par chauffage, l'hydroxyde de cuivre \text{Cu}(\text{OH})_2 se déshydrate en oxyde de cuivre
b. La réaction entre le métal cuivre et l'acide nitrique produit des fumées rousses toxiques de dioxyde d'azote \text{NO}_2 et des ions cuivre \text{Cu}^{2+} donnant une couleur bleue à la solution.
c. L'ion cuivre réagit avec une solution d'hydroxyde de sodium (\text{Na}^+ ; \text{HO}^-) en donnant un précipité bleu d'hydroxyde de cuivre. Les ions sodium \text{Na}^+ sont spectateurs.
d. Un mélange de poudre de carbone \text{C} et d'oxyde de cuivre \text{CuO} chauffé de façon homogène donne du métal cuivre et produit un dégagement gazeux.
b. La réaction entre le métal cuivre et l'acide nitrique produit des fumées rousses toxiques de dioxyde d'azote \text{NO}_2 et des ions cuivre \text{Cu}^{2+} donnant une couleur bleue à la solution.
c. L'ion cuivre réagit avec une solution d'hydroxyde de sodium (\text{Na}^+ ; \text{HO}^-) en donnant un précipité bleu d'hydroxyde de cuivre. Les ions sodium \text{Na}^+ sont spectateurs.
d. Un mélange de poudre de carbone \text{C} et d'oxyde de cuivre \text{CuO} chauffé de façon homogène donne du métal cuivre et produit un dégagement gazeux.
Doc. 2
Étape 1 de la réaction


1. Remettre les différentes étapes expliquées ci-dessous (doc. 1) dans le bon ordre pour qu'à partir du cuivre métal, on passe par quatre réactions successives pour obtenir à nouveau du cuivre métal.
2. À l'aide de la question précédente, établir un schéma
bilan permettant de rendre compte de l'état chimique du cuivre à chaque étape et du réactif avec lequel se
fait la réaction entre deux étapes.
3. Chacune des étapes, sauf la première, peut être traduite par une équation.
a. Quelles sont les espèces spectatrices ?.
b. Écrire l'équation de la réaction de l'étape n° 2.
c. Déshydrater signifie enlever l'eau. En déduire l'équation de la réaction de l'étape n° 3.
d. Si on relie le tube à essai siège de la réaction n° 4 à un tube contenant de l'eau de chaux, on constate qu'elle se trouble. En déduire l'équation de la réaction correspondant à l'étape n° 4.
4. Pourquoi cette suite d'expériences est-elle un exemple de la conservation de l'élément chimique ?
Cliquez pour accéder à une zone de dessin
3. Chacune des étapes, sauf la première, peut être traduite par une équation.
a. Quelles sont les espèces spectatrices ?.
b. Écrire l'équation de la réaction de l'étape n° 2.
c. Déshydrater signifie enlever l'eau. En déduire l'équation de la réaction de l'étape n° 3.
d. Si on relie le tube à essai siège de la réaction n° 4 à un tube contenant de l'eau de chaux, on constate qu'elle se trouble. En déduire l'équation de la réaction correspondant à l'étape n° 4.
4. Pourquoi cette suite d'expériences est-elle un exemple de la conservation de l'élément chimique ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
30Question d'équilibre !
✔ MOD : Écrire et ajuster des équations de transformations
1.
Ajuster les équations suivantes.
a. \text{CO}(g) + \text{O}_2(g) \rightarrow \text{CO}_2 (g).
b. \text{I}_2 \text{(g)} + \text{SO}^{2-}_{4} \text{(aq)} \rightarrow \text{I}^- \text{(aq)} + \text{S}_2\text{O}^{2-}_8 \text{(aq)}.
c. \text{CH}_4 \text{(g)} + \text{O}_2 \text{(g)} \rightarrow \text{CO}_2 \text{(g)} + \text{H}_2\text{O}\text{(l).}
d. \text{CO}\text{(g)} + \text{NO}\text{(g)} \rightarrow\text{CO}_2 \text{(g)} + \text{N}_2 \text{(g)}.
2. Ajuster les équations suivantes.
a. \text{CH}_3\text{OH(l)} + \text{O}_2 \text{(g)} \rightarrow \text{CO}_2 \text{(g)} + \text{H}_2\text{O(l)}.
b. \text{Al(s)} + \text{O}_2 \text{(g)} \rightarrow \text{Al}_2\text{O}_3 \text{(s)}.
a. \text{CO}(g) + \text{O}_2(g) \rightarrow \text{CO}_2 (g).
b. \text{I}_2 \text{(g)} + \text{SO}^{2-}_{4} \text{(aq)} \rightarrow \text{I}^- \text{(aq)} + \text{S}_2\text{O}^{2-}_8 \text{(aq)}.
c. \text{CH}_4 \text{(g)} + \text{O}_2 \text{(g)} \rightarrow \text{CO}_2 \text{(g)} + \text{H}_2\text{O}\text{(l).}
d. \text{CO}\text{(g)} + \text{NO}\text{(g)} \rightarrow\text{CO}_2 \text{(g)} + \text{N}_2 \text{(g)}.
2. Ajuster les équations suivantes.
a. \text{CH}_3\text{OH(l)} + \text{O}_2 \text{(g)} \rightarrow \text{CO}_2 \text{(g)} + \text{H}_2\text{O(l)}.
b. \text{Al(s)} + \text{O}_2 \text{(g)} \rightarrow \text{Al}_2\text{O}_3 \text{(s)}.
c.
\text{C}_6\text{H}_6 \text{(g) }+ \text{O}_2 \text{(g)} \rightarrow \text{CO}_2 (\text{g}) + \text{H}_2\text{O(l)}.
d. \text{Cu}^{2+}\text{(aq)} + \text{Al(s)} \rightarrow \text{Cu(s)} + \text{Al}^{3+}\text{(aq)}.
3. Ajuster les équations suivantes.
a. \text{C}_7\text{H}_8 \text{(g)} + \text{O}_2 (\text{g}) \rightarrow \text{CO}_2 \text{(g) }+ \text{H}_2\text{O(l)}.
b. \text{CO(g)} + \text{NO}_2 \text{(g) } \rightarrow \text{CO}_2 \text{(g)} + \text{N}_2 \text{(g)}.
c. \text{Fe}^{3+}\text{(aq)} + \text{I}^-\text{(aq)} \rightarrow \text{I}_2 \text{(g)} +\text{ Fe(s)}.
d. \text{NO}_{3}^{-}\text{(aq)} + \text{Fe}^{2+}\text{(aq)} + \text{H}^+(aq) \rightarrow \text{NO(g)} + \text{H}_2\text{O(l)} + \text{Fe}^{3+}\text{(aq)}.
d. \text{Cu}^{2+}\text{(aq)} + \text{Al(s)} \rightarrow \text{Cu(s)} + \text{Al}^{3+}\text{(aq)}.
3. Ajuster les équations suivantes.
a. \text{C}_7\text{H}_8 \text{(g)} + \text{O}_2 (\text{g}) \rightarrow \text{CO}_2 \text{(g) }+ \text{H}_2\text{O(l)}.
b. \text{CO(g)} + \text{NO}_2 \text{(g) } \rightarrow \text{CO}_2 \text{(g)} + \text{N}_2 \text{(g)}.
c. \text{Fe}^{3+}\text{(aq)} + \text{I}^-\text{(aq)} \rightarrow \text{I}_2 \text{(g)} +\text{ Fe(s)}.
d. \text{NO}_{3}^{-}\text{(aq)} + \text{Fe}^{2+}\text{(aq)} + \text{H}^+(aq) \rightarrow \text{NO(g)} + \text{H}_2\text{O(l)} + \text{Fe}^{3+}\text{(aq)}.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
31Acide et base
✔ MOD : Utiliser de façon rigoureuse le modèle de l'énergie

La réaction entre une solution d'acide chlorhydrique (\text{H}_3\text{O}^+; \text{Cl}^-) et une solution basique d'hydroxyde de sodium (\text{Na}^+; \text{HO}^-) produit de l'eau.
1. Écrire l'équation de la transformation.
2. Identifier les deux espèces spectatrices.
1. Écrire l'équation de la transformation.
2. Identifier les deux espèces spectatrices.
On réalise trois transformations dans les proportions indiquées ci-dessous :
1 L de solution acide contient 36,5 g de (\text{H}_3\text{O}^+ ; \text{Cl}^-) et 1 L de solution basique contient 40 g de (\text{Na}^+; \text{HO}^-).
On ajoute quelques gouttes de bleu de bromothymol à chaque transformation. C'est un indicateur de la présence d'ions oxonium \text{H}_{3}\text{O}^+ : en sa présence, la solution apparaît jaune. En son absence, elle est bleue.
|
Numéro de la réaction | 1 | 2 | 3 |
|
Volume de solution d'acide (mL) | 20 | 10 | 1 |
|
Volume de solution basique (mL) | 10 | 20 | 20 |
1 L de solution acide contient 36,5 g de (\text{H}_3\text{O}^+ ; \text{Cl}^-) et 1 L de solution basique contient 40 g de (\text{Na}^+; \text{HO}^-).
On ajoute quelques gouttes de bleu de bromothymol à chaque transformation. C'est un indicateur de la présence d'ions oxonium \text{H}_{3}\text{O}^+ : en sa présence, la solution apparaît jaune. En son absence, elle est bleue.
3.
Pour le premier mélange, justifier le fait que la solution apparaisse jaune.
4. Quel est le réactif limitant pour le mélange 2 ? et 3 ?
4. Quel est le réactif limitant pour le mélange 2 ? et 3 ?
Entre l'état initial et l'état final pour le mélange n° 2, on constate que la température a augmenté de 3 °C.
5. Cette réaction est-elle endothermique ou exothermique ?
6. Comment va varier cette augmentation pour le mélange n° 3 ?
5. Cette réaction est-elle endothermique ou exothermique ?
6. Comment va varier cette augmentation pour le mélange n° 3 ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AÉmissions de \text{CO}_2
✔ MOD : Modéliser une transformation chimique
L'essence est un hydrocarbure que l'on peut modéliser par une molécule de formule \text{C}_7\text{H}_{16}.
Masse volumique de l'essence : \rho=0,75 \mathrm{~kg} \cdot \mathrm{L}^{-1}
Masse d'une mole d'essence : \mathrm{M}\left(\mathrm{C}_{7} \mathrm{H}_{16}\right)=100 \mathrm{~g} \cdot \mathrm{mol}^{-1}
Masse d'une mole de \text{CO}_2 : \mathrm{M}\left(\mathrm{CO}_{2}\right)=44,0 \mathrm{~g} \cdot \mathrm{mol}^{-1}
L'essence est un hydrocarbure que l'on peut modéliser par une molécule de formule \text{C}_7\text{H}_{16}.
1. Ajuster l'équation de la réaction de combustion de l'essence :
\ldots \mathrm{C}_{7} \mathrm{H}_{16}+\ldots \mathrm{O}_{2} \rightarrow \ldots \mathrm{CO}_{2}+\ldots \mathrm{H}_{2} \mathrm{O}
2. Quelle masse de \text{CO}_2 est émise lors de la combustion complète d'un litre d'essence ?
\ldots \mathrm{C}_{7} \mathrm{H}_{16}+\ldots \mathrm{O}_{2} \rightarrow \ldots \mathrm{CO}_{2}+\ldots \mathrm{H}_{2} \mathrm{O}
2. Quelle masse de \text{CO}_2 est émise lors de la combustion complète d'un litre d'essence ?
Données
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BDosage colorimétrique
✔ MOD : Modéliser une transformation chimique
Un laboratoire souhaite déterminer avec précision la concentration d'une solution de permanganate de potassium (qui contient des ions \text{K}^+ et \text{MnO}_4^-), utilisée en médecine comme désinfectant. Pour cela, il fait réagir les ions \text{MnO}_4^- d'un prélèvement de la solution avec de l'acide oxalique (\text{C}_2\text{H}_2\text{O}_4) et mesure la quantité d'acide oxalique nécessaire pour que tous les ions \text{MnO}_4^- réagissent. Il se passe la transformation suivante :
5 \mathrm{C}_{2} \mathrm{H}_{2} \mathrm{O}_{4}+2 \mathrm{MnO}_{4}^{-}+6 \mathrm{H}^{+} \rightarrow \ldots \mathrm{CO}_{2}+\ldots \mathrm{Mn}^{2+}+\ldots \mathrm{H}_{2} \mathrm{O}
L'ion \text{MnO}_4^-, de couleur violette, est la seule espèce colorée présente ici.
1. Comment s'appelle l'ion \text{K}^+ ?
2. a. Si on ajoute trop peu d'acide oxalique, quel réactif sera le réactif limitant ?
b. De quelle couleur sera la solution après la transformation ?
5 \mathrm{C}_{2} \mathrm{H}_{2} \mathrm{O}_{4}+2 \mathrm{MnO}_{4}^{-}+6 \mathrm{H}^{+} \rightarrow \ldots \mathrm{CO}_{2}+\ldots \mathrm{Mn}^{2+}+\ldots \mathrm{H}_{2} \mathrm{O}
L'ion \text{MnO}_4^-, de couleur violette, est la seule espèce colorée présente ici.
1. Comment s'appelle l'ion \text{K}^+ ?
2. a. Si on ajoute trop peu d'acide oxalique, quel réactif sera le réactif limitant ?
b. De quelle couleur sera la solution après la transformation ?
3. a. Si on ajoute beaucoup d'acide oxalique, quel réactif sera le réactif limitant ?
b. De quelle couleur sera la solution après la transformation ?
4. Recopier et ajuster l'équation de la réaction.
5. On constate (grâce au changement de couleur), que pour faire réagir tous les ions \text{MnO}_4^-, il faut ajouter 15 mmol d'acide oxalique. Quelle quantité de matière de \text{MnO}_4^- contient le prélèvement ?
b. De quelle couleur sera la solution après la transformation ?
4. Recopier et ajuster l'équation de la réaction.
5. On constate (grâce au changement de couleur), que pour faire réagir tous les ions \text{MnO}_4^-, il faut ajouter 15 mmol d'acide oxalique. Quelle quantité de matière de \text{MnO}_4^- contient le prélèvement ?
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

