Chapitre 7
Exercices
Pour s'entraîner
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21Sur une assiette froide (1)
✔ APP : Maîtriser le vocabulaire du cours
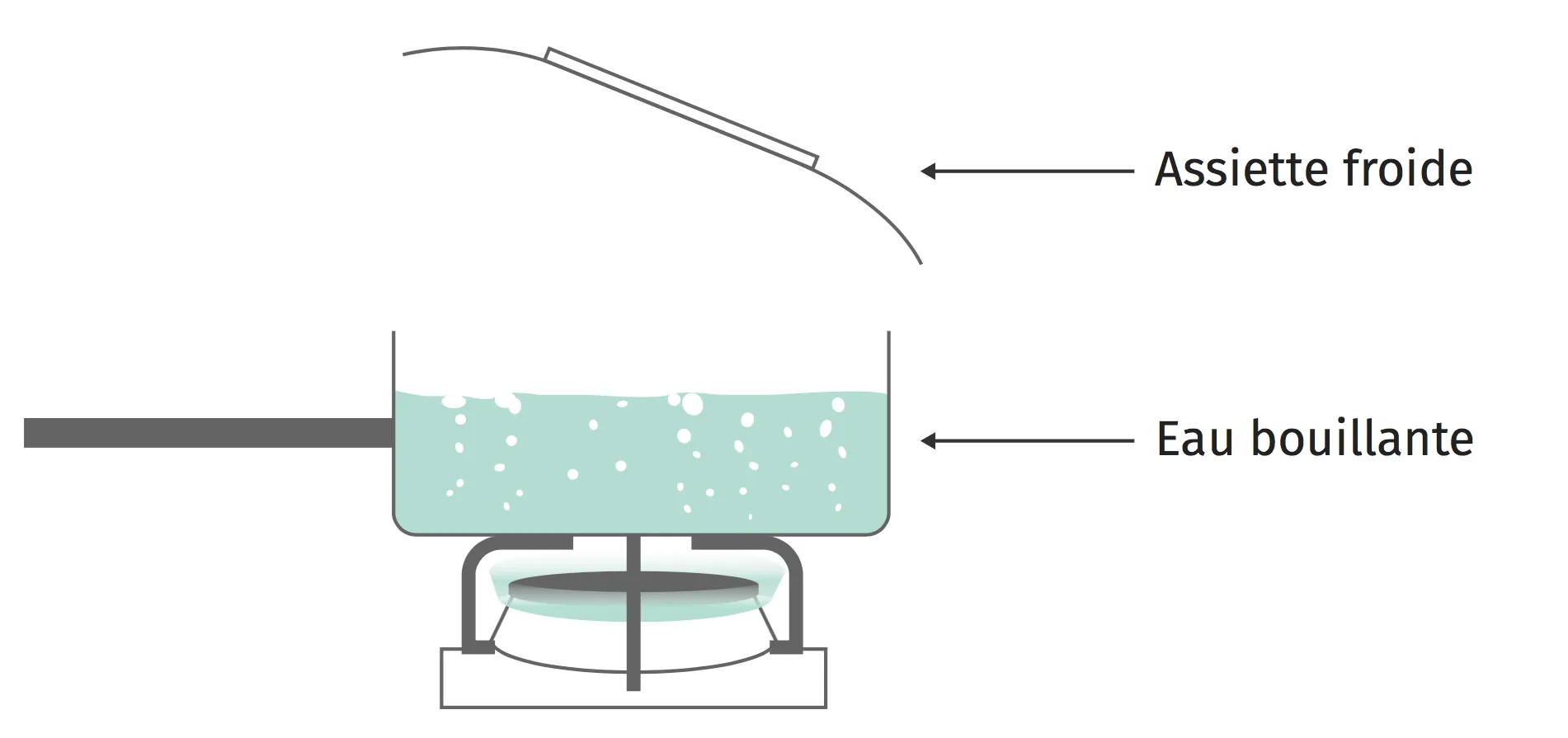
1. Quel changement d'état physique peut-on observer sur l'assiette froide ?
Écrire l'équation de ce changement d'état.
2. Modéliser la situation en représentant à l'échelle moléculaire les molécules d'eau au-dessus de la casserole et sur l'assiette.
3. Expliquer ce changement d'état à l'échelle moléculaire en utilisant les mots suivants : liaisons intermoléculaires, agitation, ordonnées.
2. Modéliser la situation en représentant à l'échelle moléculaire les molécules d'eau au-dessus de la casserole et sur l'assiette.
Cliquez pour accéder à une zone de dessin
3. Expliquer ce changement d'état à l'échelle moléculaire en utilisant les mots suivants : liaisons intermoléculaires, agitation, ordonnées.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22Sur une assiette froide (2)
✔ MOD : Utiliser de façon rigoureuse le modèle de l'énergie1. L'eau bouillante dans la casserole capte-t-elle de l'énergie ?
2. La transformation subie par l'eau est-elle exothermique ou endothermique ?
3. La vapeur d'eau au contact de l'assiette capte-t-elle ou libère-t-elle de l'énergie ?
4. La transformation subie par la vapeur d'eau est-elle exothermique ou endothermique ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23Libérer ou capter la chaleur
✔ MOD : Utiliser de façon rigoureuse le modèle de l'énergie
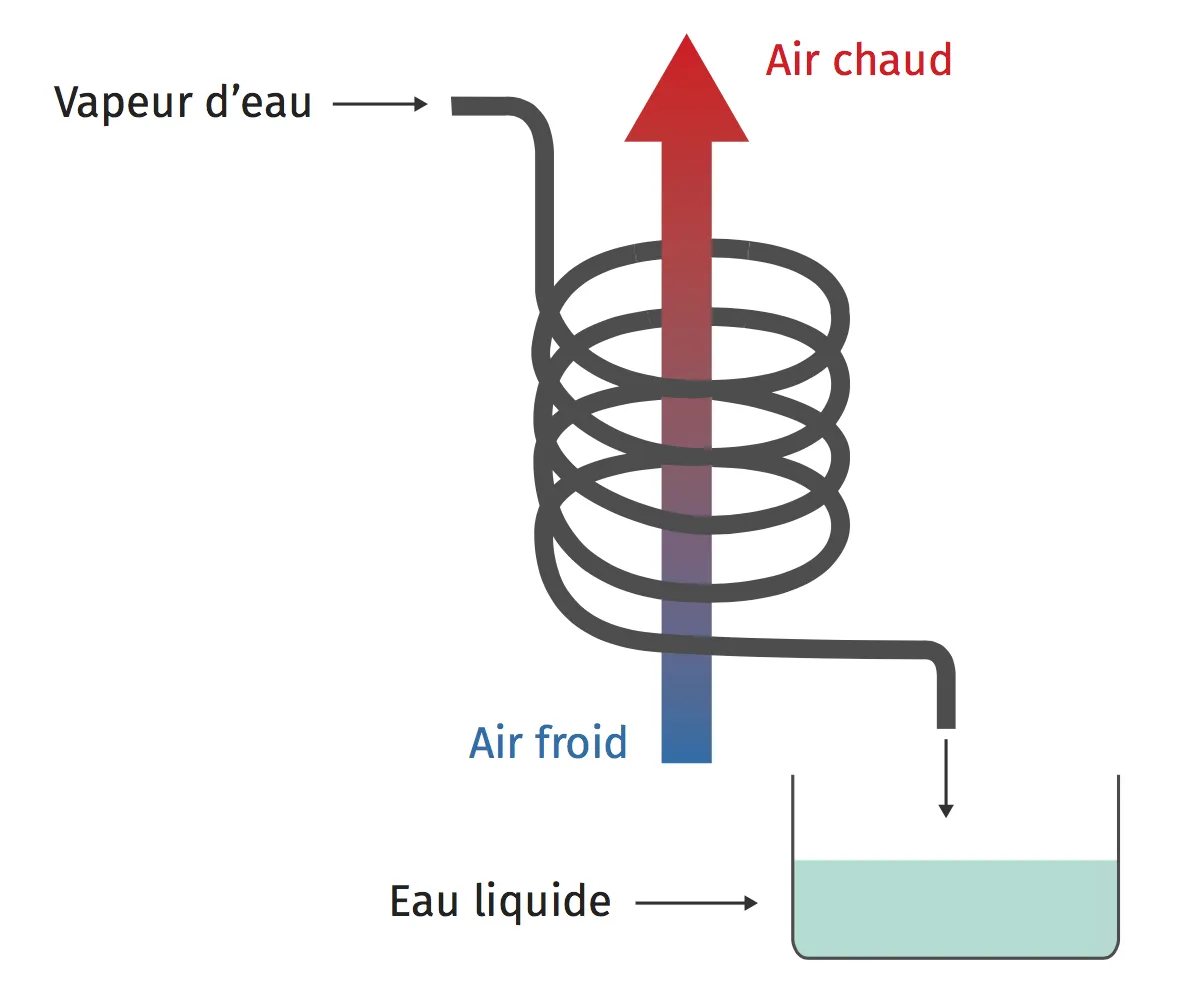
De la vapeur d'eau pénètre dans le tuyau par le haut puis circule dans le serpentin. De l'eau liquide est récupérée à la sortie en bas.
1.
Écrire l'équation du changement d'état subi par l'eau et donner son nom.
2. Le changement d'état subi par l'eau est-il exothermique ou endothermique ? Justifier la réponse en s'appuyant sur le schéma.
3. À quoi peut servir ce dispositif ?
2. Le changement d'état subi par l'eau est-il exothermique ou endothermique ? Justifier la réponse en s'appuyant sur le schéma.
3. À quoi peut servir ce dispositif ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24
Comprendre les attendus
Climatisation automobile
✔ MATH : Pratiquer le calcul numérique : puissances de 10
Dans les pompes à chaleur qui assurent le fonctionnement des climatiseurs circule un fluide appelé fluide frigorigène. Ce fluide subit une série de changements d'état physique (voir [DIFF]) et permet ainsi des échanges thermiques. Dans le cas du fluide R-1234yf destiné à la climatisation automobile ( fluide frigorigène de 4e génération, réduisant l'impact environnemental, et ayant une meilleure efficacité énergétique).
1. Dans l'évaporateur, le fluide passe de l'état liquide à l'état gazeux. L'énergie transférée est alors de 607\text{,}6 \times 10^3 J. Calculer la masse de fluide concernée par ce changement d'état.
2. Quel volume de liquide cela représente-t-il ?
3. Dans le condenseur, le fluide subit une liquéfaction. Sans faire de calcul, quelle serait la quantité d'énergie transférée dans le condenseur ? Cette énergie est-elle captée ou libérée par le fluide ?
Dans les pompes à chaleur qui assurent le fonctionnement des climatiseurs circule un fluide appelé fluide frigorigène. Ce fluide subit une série de changements d'état physique (voir [DIFF]) et permet ainsi des échanges thermiques. Dans le cas du fluide R-1234yf destiné à la climatisation automobile ( fluide frigorigène de 4e génération, réduisant l'impact environnemental, et ayant une meilleure efficacité énergétique).
1. Dans l'évaporateur, le fluide passe de l'état liquide à l'état gazeux. L'énergie transférée est alors de 607\text{,}6 \times 10^3 J. Calculer la masse de fluide concernée par ce changement d'état.
2. Quel volume de liquide cela représente-t-il ?
3. Dans le condenseur, le fluide subit une liquéfaction. Sans faire de calcul, quelle serait la quantité d'énergie transférée dans le condenseur ? Cette énergie est-elle captée ou libérée par le fluide ?
Données
- T_\text{fusion}\text{(R-1234yf)}= -53\text{,}15 °C ;
- T_\text{ébullition}\text{(R-1234yf)}= -29\text{,}49 °C ;
- L_\text{vaporisation}= 180\text{,}0 kJ·kg-1au point d'ébullition ;
- L_\text{fusion}= 93\text{,}3 kJ·kg-1au point de fusion ;
- Masse volumique du R-1234yf liquide : \rho = 1\text{,}263 kg·dm-3.
Détails du barème
TOTAL /5,5 pts
1 pt
1. Écrire l'expression littérale de la masse en fonction des autres grandeurs.0,5 pt
1. Convertir les kJ en J.0,5 pt
1. Faire la bonne application numérique avec les puissances de 10.0,5 pt
2. Écrire l'expression littérale du volume.1 pt
2. Calculer en précisant l'unité du résultat.2 pts
3. Justifier la réponse par un raisonnement.Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AMachine à vapeur
✔ MATH : Pratiquer le calcul numérique
Le principe de la machine à vapeur est de vaporiser de l'eau afin d'actionner un piston. Lors de la première révolution industrielle, le principal combustible utilisé était le charbon.
1. La combustion du charbon est-elle une transformation endothermique ou exothermique ?
2. Quelle masse d'eau peut-on vaporiser en brûlant 5,0 kg de charbon ?
1. La combustion du charbon est-elle une transformation endothermique ou exothermique ?
2. Quelle masse d'eau peut-on vaporiser en brûlant 5,0 kg de charbon ?
3. En réalité, la masse d'eau vaporisée est bien moins importante, expliquer pourquoi.
Données
- Énergie (par unité de masse) libérée par la combustion du charbon : 35 \times 10^3 J·g-1
- L_{\text{vaporisation}}(\text{H}_2\text{O}) = 2,26 \times 10^3 J·g-1
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
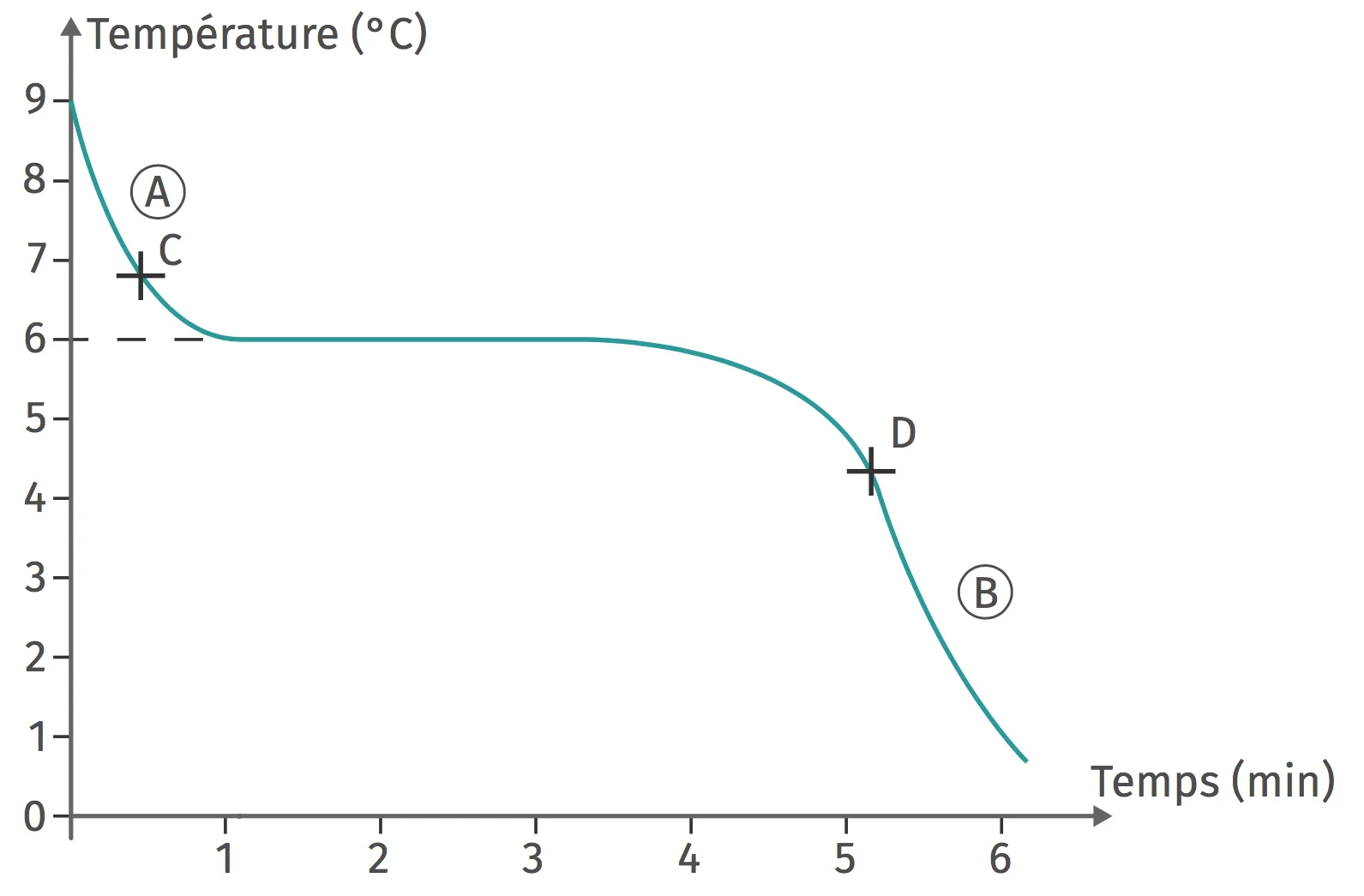
25Le cyclohexane
✔ ANA : Faire le lien entre les modèles microscopiques et les
grandeurs macroscopiques
Le graphique ci-dessous représente l'évolution de la température en fonction du temps lorsque l'on refroidit du cyclohexane liquide de formule chimique \text{C}_{6}\text{H}_{12}.

De la vapeur d'eau pénètre dans le tuyau par le haut puis circule dans le serpentin. De l'eau liquide est récupérée à la sortie en bas.


De la vapeur d'eau pénètre dans le tuyau par le haut puis circule dans le serpentin. De l'eau liquide est récupérée à la sortie en bas.
1.
Préciser les états physiques du cyclohexane sur les parties A et B du graphique.
2. Les liaisons intermoléculaires sont-elles les plus faibles au point C ou au point D ? Expliquer la réponse du point de vue de l'énergie transférée.
3. L'état est-il plus ordonné au point C ou au point D ?
2. Les liaisons intermoléculaires sont-elles les plus faibles au point C ou au point D ? Expliquer la réponse du point de vue de l'énergie transférée.
3. L'état est-il plus ordonné au point C ou au point D ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
26Le PVD
✔ APP : Faire un brouillon comprenant un schéma, données
et notions
✔ MOD : Modéliser une transformation physique


✔ MOD : Modéliser une transformation physique


Le PVD (Physical Vapor Deposition) est un procédé qui permet de déposer sous vide des films minces de matière. Il est utilisé en horlogerie, dans l'industrie, etc., afin de recouvrir une surface et lui donner des propriétés spécifiques. Cette technique consiste à chauffer sous vide le matériau à déposer afin de
le vaporiser par sublimation. Par la suite, la formation des couches minces par dépôt physique en phase vapeur sur un substrat (métaux, céramiques, polymères, verres) est le résultat de la condensation solide des particules de matériau. Le mode de croissance des couches ainsi que les conditions de dépôt (température, nature du substrat, etc.) influencent les orientations cristallographiques.
1.
Au brouillon, récolter toutes les informations concernant le matériau à déposer. Les organiser.
2. Faire un schéma à l'échelle moléculaire représentant les deux changements d'état physique mis en jeu ainsi que les échanges d'énergie.
3. Écrire les équations de changement d'état en jeu et préciser si les transformations sont exothermiques ou endothermiques.
4. Le solide déposé est-il un solide amorphe ou cristallin ? .
Cliquez pour accéder à une zone de dessin
2. Faire un schéma à l'échelle moléculaire représentant les deux changements d'état physique mis en jeu ainsi que les échanges d'énergie.
Cliquez pour accéder à une zone de dessin
3. Écrire les équations de changement d'état en jeu et préciser si les transformations sont exothermiques ou endothermiques.
4. Le solide déposé est-il un solide amorphe ou cristallin ? .
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
27L'aluminium
✔ MATH : Calcul littéral✔ COM : Associer les bonnes unités aux grandeurs physiques
L'aluminium est un métal solide à température ambiante (T_\text{fusion} = 660 °C).
1. Quelle masse de métal pourrait-on faire fondre à 660 °C en transférant une quantité d'énergie de 1\text{,}04 \times 10^7 J ?
1. Quelle masse de métal pourrait-on faire fondre à 660 °C en transférant une quantité d'énergie de 1\text{,}04 \times 10^7 J ?
2.
Calculer le volume d'aluminium correspondant.
Données
- L_\text{fusion}\text{(aluminium)}= 399\text{,}6 kJ·kg-1 au point de fusion ;
- Masse volumique de l'aluminium : \rho_\text{Al} = 2\text{,}7 \times 10^{3} kg·m-3.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
28
Copie d'élève à commenter
Proposer une justification pour chaque erreur relevée par le correcteur.
1.
Le cuivre, à température ambiante, est à l'état liquide car sa température de fusion est de 1\,084\, ^{\circ}\text{C}.
2. À l'état solide, les atomes sont libresde se déplacer.
3.
Sachant que L_\text{fusion cuivre} = 205\text{,}5\, \text{kJ}\cdot\text{kg}^{-1}, Q = 2\text{,}23 \times 10^7 \,\text{J} et m = \dfrac{Q}{L_\text{fusion}} alors :
m = \dfrac{2\text{,}23 \times 10^7}{\sout{205\text{,}5}} soit m = \xcancel{1\text{,}08 \times 10^5\, \text{g}}.
4.
Sachant que \rho_\text{cu} = 8\text{,}96 \times 10^{3} \, \text{kg}\cdot\text{m}^{-3} et V = \xcancel{m \cdot \rho} alors :
\sout{V} = \sout{1\text{,}08} \times 10^5 \times 8\text{,}96 = \xcancel{9\text{,}68} \times 10^5 \,\text{kg}.
2. À l'état solide, les atomes sont libres
m = \dfrac{2\text{,}23 \times 10^7}{\sout{205\text{,}5}} soit m = \xcancel{1\text{,}08 \times 10^5\, \text{g}}.
\sout{V} = \sout{1\text{,}08} \times 10^5 \times 8\text{,}96 = \xcancel{9\text{,}68} \times 10^5 \,\text{kg}.
5.
L'énergie massique de changement d'état de ce métal est donc de :
L = 64\text{,}9 \,\xcancel{\text{kg}\cdot\text{kJ}^{-1} }.
6.état liquide ;
état gazeux .

6.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BDu sel pour refroidir
✔ MOD: Modéliser une transformation physique
Une vieille astuce consiste à rajouter du sel dans un seau à glace afin d'accélérer le refroidissement des bouteilles ou canettes que l'on y introduit. En effet, en se dissolvant dans l'eau, le sel capte de l'énergie, et donc refroidit son environnement.
1. Écrire l'équation de changement d'état correspondant à la dissolution du sel (\text{NaCl}).
2. Représenter schématiquement cette transformation à l'échelle moléculaire.
1. Écrire l'équation de changement d'état correspondant à la dissolution du sel (\text{NaCl}).
2. Représenter schématiquement cette transformation à l'échelle moléculaire.
Cliquez pour accéder à une zone de dessin
3. Cette transformation est-elle endothermique ou exothermique ?
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

