Chapitre 3
Activité 1 - Activité d'exploration
Décrire l'évolution d'un système chimique
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Problématique de l'activité
Le dentifrice de l'éléphant est une expérience impressionnante au cours de laquelle une gerbe de mousse est produite. Lors de la réalisation de cette expérience, il faut prévoir un bac de contenance assez importante pour pouvoir récupérer toute la mousse produite.
Comment peut-on prévoir l'état final du système ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Quel volume de gaz peut être produit par une dizaine de millilitres d'eau oxygénée ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1 Réalisation de l'expérience






Lors de cette expérience, on mélange 50 mL d'eau oxygénée à 30 % en masse avec une solution d'iodure de potassium (\text{K}^+(aq) ; \text{I}^-(aq)). Sous l'action catalytique des ions iodure \text{I}^-, la réaction de dismutation du peroxyde d'hydrogène est accélérée et le dégagement de dioxygène qui aurait dû s'effectuer sur plusieurs mois se fait en quelques instants.
Pour amplifier le côté impressionnant de l'expérience, on ajoute du liquide vaisselle. Le mélange liquide vaisselle-eau va former des bulles qui vont piéger le dioxygène : voilà le dentifrice de l'éléphant !
Pour récupérer la mousse formée, on place l'erlenmeyer dans un cristallisoir de 10 L.
Pour amplifier le côté impressionnant de l'expérience, on ajoute du liquide vaisselle. Le mélange liquide vaisselle-eau va former des bulles qui vont piéger le dioxygène : voilà le dentifrice de l'éléphant !
Pour récupérer la mousse formée, on place l'erlenmeyer dans un cristallisoir de 10 L.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
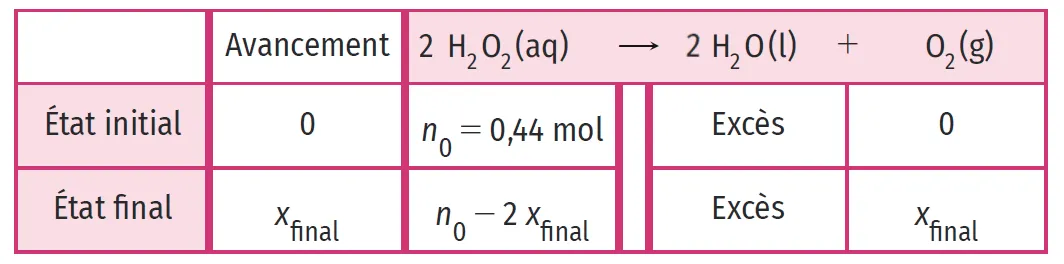
Doc. 2Tableau d'avancement et réaction totale
Le tableau d'avancement est un outil qui permet de décrire et prévoir l'évolution de systèmes chimiques. Il répertorie les quantités de matière de chaque réactif ou produit. Il fait intervenir une grandeur fictive : l'avancement noté x.
L'avancement correspond à la quantité de réactif ayant réagi ou bien de produit ayant été formé dans le cas particulier où le nombre stœchiométrique associé est égal à 1.
L'avancement correspond à la quantité de réactif ayant réagi ou bien de produit ayant été formé dans le cas particulier où le nombre stœchiométrique associé est égal à 1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3 Suivi de la réaction
La réaction de dismutation du peroxyde d'hydrogène (réaction sur lui-même) est une réaction totale. Les réactions totales ont lieu jusqu'à épuisement de l'un des réactifs.
À 20 °C le volume molaire du dioxygène est de 24 L·mol-1.

À 20 °C le volume molaire du dioxygène est de 24 L·mol-1.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Compétence(s)
RAI/MOD : Modéliser une transformation chimique
RAI/MOD : Utiliser la quantité de matière
RAI/MOD : Utiliser la quantité de matière
1. Doc. 1 Avec quel réactif le peroxyde d'hydrogène réagit-il ? Quel(s) est/sont le(s) produit(s) de cette transformation chimique ?
2. Doc. 2 Identifier le rôle de l'ion iodure \text{I}^- et du liquide vaisselle dans l'expérience du dentifrice de l'éléphant.
3. Doc. 3 Quels sont les composants de l'eau oxygénée ? Expliquer alors la raison pour laquelle il est mentionné « excès » dans la colonne de l'eau.
4. Doc. 3 Quelle est la quantité de matière finale de peroxyde d'hydrogène \text{H}_2\text{O}_2 ? En déduire la valeur de l'avancement final x_\text{final}.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Synthèse de l'activité
Calculer le volume maximal de dioxygène produit lors de la réaction. Le cristallisoir utilisé est-il de taille suffisante ?
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

