Chapitre 3
Exercices
Pour s'échauffer - Pour commencer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour s'échauffer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
5 Deux exemples de transformations
S'agit-il de transformations physique ou chimique ? a. \mathrm{CaCO}_{3}(\mathrm{s}) \rightarrow \mathrm{Ca}^{2+}(\mathrm{aq})+\mathrm{CO}_{3}^{2-}(\mathrm{aq}) \qquad
b. \mathrm{CaCO}_{3}(\mathrm{s}) \rightarrow \mathrm{CaO}(\mathrm{s})+\mathrm{CO}_{2}(\mathrm{g})\qquad
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
6 Loi de conservation
Au cours d'une transformation chimique, observe-t-on la conservation :Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
7L'avancement x
À quoi correspond l'avancement d'une réaction pour
une équation dans laquelle tous les coefficients stœchiométriques valent 1 ?Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
8L'état initial d'une réaction
Doit-on prendre en compte les coefficients stœchiométriques d'une équation bilan pour définir l'état initial ?Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9xmax(1) et xmax(2)
Pourquoi est-on susceptible de trouver plusieurs valeurs pour x_\text{max} ? Pourquoi est-ce la plus petite des deux valeurs qui est la bonne ?Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
10Les conditions stœchiométriques
À quel état du système chimique correspondent-elles
en fin de réaction ? Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11Le réactif limitant
Est-ce forcément celui dont la quantité de matière initiale est la plus faible ?Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour commencer
Relier quantité de matière et transformation chimique
Relier quantité de matière et transformation chimique
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
12 Comprendre une équation bilan
✔ RAI/MOD : Modéliser une transformation chimique
La modélisation de la combustion du méthane peut s'écrire :
...\mathrm{CH}_{4}(\mathrm{g}) + ...\mathrm{O}_{2}(\mathrm{g}) \rightarrow ...\mathrm{CO}_{2}(\mathrm{g}) + ...\mathrm{H}_{2} \mathrm{O}(\mathrm{g}).
1. Équilibrer cette équation bilan.
\mathrm{CH}_{4}(\mathrm{g}) + \mathrm{O}_{2}(\mathrm{g}) \rightarrow \mathrm{CO}_{2}(\mathrm{g}) + \mathrm{H}_{2} \mathrm{O}(\mathrm{g}).
2. Quelle information apporte cette équation bilan ?
3. Comment appelle-t-on les coefficients devant le symbole des molécules ? Ont-ils une signification à l'échelle microscopique ? macroscopique ?
...\mathrm{CH}_{4}(\mathrm{g}) + ...\mathrm{O}_{2}(\mathrm{g}) \rightarrow ...\mathrm{CO}_{2}(\mathrm{g}) + ...\mathrm{H}_{2} \mathrm{O}(\mathrm{g}).
1. Équilibrer cette équation bilan.
2. Quelle information apporte cette équation bilan ?
3. Comment appelle-t-on les coefficients devant le symbole des molécules ? Ont-ils une signification à l'échelle microscopique ? macroscopique ?


Torchère de gaz (Lincolnshire, Angleterre).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
13 Changer d'échelle : du microscopique au macroscopique
✔ RAI/MOD : Modéliser une transformation chimique
En cours de chimie, l'utilisation de modèles moléculaires est courante. Ils permettent de montrer la conservation de la matière lors d'une transformation chimique, comme ci-dessous lors de la décomposition de l'eau.

1.
Écrire l'équation bilan correspondante.
2. De ces deux interprétations, laquelle est la bonne ?
2. De ces deux interprétations, laquelle est la bonne ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
14Utiliser des nombres fractionnels
✔ APP : Maîtriser le vocabulaire du coursEn présence d'alcool, les ions dichromate \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-} se transforment en ions chrome (III) \mathrm{Cr}^{3+} (passage de l'orange au vert). L'équation bilan correspondante est :
\mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}(\mathrm{aq})+\dfrac{3}{2} \mathrm{C}_{2} \mathrm{H}_{5} \mathrm{OH}(\mathrm{l})+8 \mathrm{H}^{+}(\mathrm{aq}) \rightarrow \dfrac{3}{2} \mathrm{CH}_{3} \mathrm{CO}_{2} \mathrm{H}(\mathrm{l})+2 \mathrm{Cr}^{3+}(\mathrm{aq})+\dfrac{11}{2} \mathrm{H}_{2} \mathrm{O}(\mathrm{l})
1.
Est-il possible d'écrire une équation bilan de cette manière ? Expliquer.2. Réécrire cette équation ajustée avec des coefficients stœchiométriques non fractionnaires.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Les conditions stœchiométriques
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15Relier quantité de matière et nombres stœchiométriques - Identifier la conservation de la masse
✔ RAI/MOD : La quantité de matière
1.
Équilibrer l'équation bilan ci-dessous.

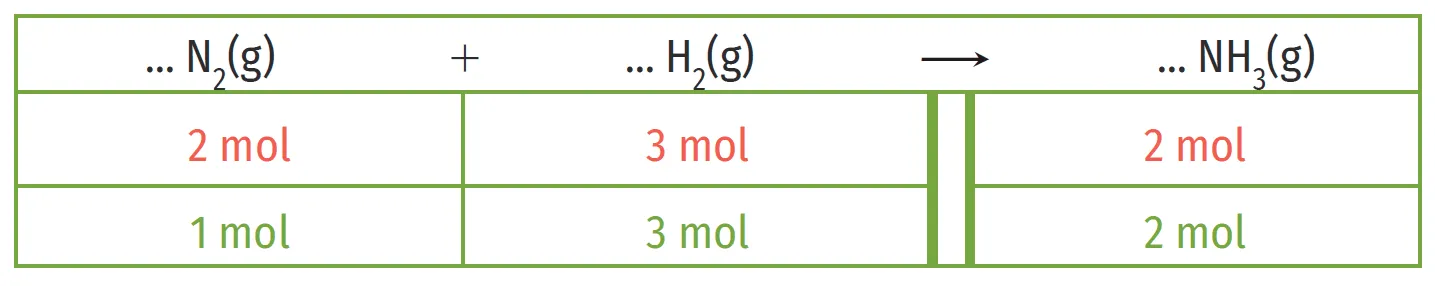
2. Des deux propositions, rouge et verte, laquelle correspond aux conditions stœchiométriques ? Justifier en s'appuyant sur ses connaissances.


1
2
3
2. Des deux propositions, rouge et verte, laquelle correspond aux conditions stœchiométriques ? Justifier en s'appuyant sur ses connaissances.
On suppose qu'on fait réagir 8,0 g de diazote (\mathrm{N}_{2}) pour
obtenir 9,7 g d'ammoniac (\mathrm{NH}_{3}).
3. A priori, quelle masse de dihydrogène aura réagi ?
4. Si la masse initiale de dihydrogène est de m(\text{H}_2) = 1,7 g, les conditions stœchiométriques seront-elles respectées ?
M(\text{H}) =1,0 g·mol-1;
M(\text{N}) =14,0 g·mol-1.
3. A priori, quelle masse de dihydrogène aura réagi ?
4. Si la masse initiale de dihydrogène est de m(\text{H}_2) = 1,7 g, les conditions stœchiométriques seront-elles respectées ?
Données
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
16Calculer une quantité de matière
✔ RAI/MOD : La quantité de matière
La soudure aluminothermique permet de relier les rails du chemin de fer entre elles. Elle s'appuie sur :


\mathrm{Fe}_{2} \mathrm{O}_{3}(\mathrm{s})+2\, \mathrm{Al}(\mathrm{s}) \rightarrow 2\, \mathrm{Fe}(\mathrm{s})+\mathrm{Al}_{2} \mathrm{O}_{3}(\mathrm{s})


1.
On cherche à calculer la masse d'aluminium qui sera nécessaire pour faire réagir 3,00 g d'oxyde de fer, initialement présent dans les conditions stœchiométriques. Pour cela :
a. Calculer la quantité de matière initiale d'oxyde de fer.
b. En déduire l'avancement maximal x_{\text{max}}.
c. En déduire la quantité de matière nécessaire d'aluminium pour que la réaction soit totale.
d. Calculer la masse d'aluminium correspondante.
a. Calculer la quantité de matière initiale d'oxyde de fer.
b. En déduire l'avancement maximal x_{\text{max}}.
c. En déduire la quantité de matière nécessaire d'aluminium pour que la réaction soit totale.
d. Calculer la masse d'aluminium correspondante.
2.
Déterminer la masse de chacun des produits.
3. Le principe de conservation de la masse est-il appliqué ?
3. Le principe de conservation de la masse est-il appliqué ?
Données
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17Vrai ou faux ? Différencier masse et quantité de matière
✔ APP : Maîtriser le vocabulaire du coursSoit l'équation bilan suivante (combustion du glucose) :
\mathrm{C}_{6} \mathrm{H}_{12} \mathrm{O}_{6}(\mathrm{s})+6\, \mathrm{O}_{2}(\mathrm{g}) \rightarrow 6\, \mathrm{CO}_{2}(\mathrm{g})+6\, \mathrm{H}_{2} \mathrm{O}(\mathrm{l})
En se plaçant dans les conditions stœchiométriques, les affirmations suivantes sont-elles vraies ou fausses ?
a.
Le rapport des masses du dioxygène et du glucose vaut 6.
b. Le rapport des quantités de matières du dioxygène et du glucose vaut 6.
b. Le rapport des quantités de matières du dioxygène et du glucose vaut 6.
c.
La quantité de matière des réactifs est égale à celle des produits.
d. La masse des réactifs est égale à celle des produits.
d. La masse des réactifs est égale à celle des produits.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Trouver le réactif limitant
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
18 Construire un tableau d'avancement
✔ RAI/MOD : Modéliser une transformation chimiqueOn fait réagir 0,34 g de méthylamine avec 0,44 cm3 de butane-2,3-dione. Il se forme une imine qui possède une odeur prononcée de pop-corn. Voici l'équation de la réaction :
\underset{\text{Butane - 2,3 - dione}}{\mathrm{C}_{2} \mathrm{O}_{2}\left(\mathrm{CH}_{3}\right)_{2}}+\underset{\text{Methylamine}}{\mathrm{NH}_{2} \mathrm{CH}_{3}} \rightarrow \underset{\text{Imine}}{\mathrm{COCN}\left(\mathrm{CH}_{3}\right)_{3}}+\underset{\text{Eau}}{\mathrm{H}_{2} \mathrm{O}}
1. Déterminer les quantités de matière des réactifs à l'état initial.
2. Construire le tableau d'avancement correspondant.
Cliquez pour accéder à une zone de dessin
3. En déduire le réactif limitant ainsi que les quantités de matière finales.
Données
\rho_\text{b} = 0,99 kg·L-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
19 Déterminer un volume de gaz
✔ RAI/MOD : Modéliser une transformation

La levure chimique est utilisée pour faire des gâteaux. Elle contient 0,2 mol d'hydrogénocarbonate de sodium (\text{NaHCO}_3) ainsi que 2 mol d'acide tartrique (qui libère 4 mol d'ions \text{H}^+), tous deux solides. À froid, en présence d'eau, on observe un dégagement de dioxyde de carbone, ce qui fait lever la pâte à pain :
\mathrm{NaHCO}_{3}(\mathrm{s})+\mathrm{H}^{+}(\mathrm{aq}) \rightarrow \mathrm{Na}^{+}(\mathrm{aq})+\mathrm{H}_{2} \mathrm{O}(\mathrm{l})+\mathrm{CO}_{2}(\mathrm{g})
1.
Déterminer le réactif limitant.
2. Calculer le volume de dioxyde de carbone ainsi produit.
Le volume molaire des gaz est pris égal à V_\text{m}= 24 L·mol-1.
2. Calculer le volume de dioxyde de carbone ainsi produit.
Données
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
20 Importance des conditions expérimentales
✔ RAI/MOD : Modéliser une transformationDans l' on étudie le mode d'action de la levure chimique à froid. Cependant, lors de la cuisson au four, la réaction se fait à chaud, et non plus à froid. L'équation bilan de la réaction est alors :
2\, \mathrm{NaHCO}_{3}(\mathrm{s}) \rightarrow \mathrm{Na}_{2} \mathrm{CO}_{3}(\mathrm{s})+\mathrm{H}_{2} \mathrm{O}(\mathrm{l})+\mathrm{CO}_{2}(\mathrm{g})
1. Pourquoi la question de la nature du réactif limitant ne se pose-t-elle plus ici ?
2. La levure contient 0,2 mol de bicarbonate de soude (\text{NaHCO}_3), déterminer le volume de gaz carbonique produit.
Données
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21Quelques calculs en QCM
✔ RAI/MOD : Modéliser une transformationOn étudie la réaction de la combustion du dihydrogène que l'on retrouve dans les réacteurs de certaines fusées :
2\, \mathrm{H}_{2}(\mathrm{l})+\mathrm{O}_{2}(\mathrm{l}) \rightarrow 2\, \mathrm{H}_{2} \mathrm{O}(\mathrm{l}).
Choisissez la ou les bonnes réponses pour chaque cas.
1.
On fait réagir 2,0 g de \text{H}_2 avec 1,0 g de \text{O}_2 :
2.
On fait réagir 0,8 mol de \text{H}_2 avec 0,4 mol de \text{O}_2 :
Données
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
ACompléter un tableau d'avancement
✔ MATH : Calcul littéral
L'eau de Javel résulte d'une réaction entre des ions hydroxyde HO- et du dichlore Cl2(g).
1. Compléter la deuxième ligne du tableau d'avancement ci-dessous.
On notera
L'eau de Javel résulte d'une réaction entre des ions hydroxyde HO- et du dichlore Cl2(g).
1. Compléter la deuxième ligne du tableau d'avancement ci-dessous.
| \text{Cl}_2\text{(g)} | \text{+ 2 HO}^-\text{{(aq)}} | \rightarrow | \text{ClO}^-\text{{(aq)}} | \text{+ Cl}^-\text{{(aq)}} | \text{+ H}_2\text{O}\text{(l)} | |
|---|---|---|---|---|---|---|
| EI (mol) | 0,12 | 0,28 | 0 | 0 | excès | |
| EInt (mol) | ||||||
| EF (mol) |
Données
On notera
- EI : État initial
- EInt : État intermédiaire
- EF : État final
- x : avancement de la réaction
2. Déterminer l'avancement maximal xmax de cette réaction. En déduire la nature du réactif limitant.
3. Compléter la dernière ligne du tableau.
4. Les réactifs ont-ils été mélangés selon les proportions stœchiométriques ?
3. Compléter la dernière ligne du tableau.
4. Les réactifs ont-ils été mélangés selon les proportions stœchiométriques ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une notion, trois exercices
Différenciation
Savoir-faire : Déterminer la composition d'un système à l'état final
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22Cas 1 (conditions stœchiométriques)
✔ RAI/MOD : Modéliser une transformation chimiqueDans le cas général, si l'équation bilan s'écrit :
\text{A}+\text{B} \rightarrow \text{C}+\text{D}.
1. Quelles sont les proportions de \text{A} et de \text{B} à respecter pour être dans les conditions stœchiométriques ?
2. Écrire alors la relation entre les masses de \text{A}, \text{B}, \text{C} et \text{D}.
3. \text{C} et \text{D} seront obtenus dans quelles proportions ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23Cas 2 (conditions stœchiométriques)
✔ RAI/MOD : Modéliser une transformation chimique
Dans le cas général, si l'équation bilan s'écrit :
Dans le cas général, si l'équation bilan s'écrit :
2\, \text{A}+\text{B} \rightarrow \text{C}+2\, \text{D}.

1.
Quelles sont les proportions de \text{A} et de \text{B} à respecter pour être dans les conditions stœchiométriques ?
2. Écrire alors la relation entre les masses de \text{A}, \text{B}, \text{C} et \text{D}.
3. \text{C} et \text{D} seront obtenus dans quelles proportions ?
2. Écrire alors la relation entre les masses de \text{A}, \text{B}, \text{C} et \text{D}.
3. \text{C} et \text{D} seront obtenus dans quelles proportions ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24Cas 3 (conditions stœchiométriques)
✔ RAI/MOD : Modéliser une transformation chimiqueDans le cas général, si l'équation bilan s'écrit :
2\, \text{A}+3\, \text{B} \rightarrow 2\, \text{C} + 2\, \text{D}.
1. Quelles sont les proportions de \text{A} et de \text{B} à respecter pour être dans les conditions stœchiométriques ?
2. Écrire alors la relation entre les masses de \text{A}, \text{B}, \text{C} et \text{D}.
3. \text{C} et \text{D} seront obtenus dans quelles proportions ?
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

