Chapitre 3
Exercice corrigé
Gaz inodore, attention danger !
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Énoncé
Compétence(s)
RAI/MOD : Modéliser une transformation
| \bf{\mathrm{CO}} en partie par million (ppm) | \bf{\mathrm{CO}} dans l'air (% volumique) | Symptôme lors d'une exposition |
| 0,2 | 0,000 02 | Aucun symptôme (taux habituel dans l'air) |
| 400 | 0,04 | Maux de tête intenses, danger de mort après 3 heures |
| 1 600 | 0,16 | Symptômes sévères après 20 min, décès dans l'heure |
| 12 800 | 1,28 | Perte de connaissance immédiate, décès en 1 à 3 min |
1. Retrouver l'équation bilan correspondant à la combustion incomplète du carbone.
2. Dresser le tableau d'avancement correspondant en supposant le dioxygène en excès. Compléter les deux premières lignes.
3. Calculer l'avancement maximal x_\text{max}. En déduire la quantité de monoxyde de carbone formé.
4. L'atmosphère de la cuve constitue-t-elle (à 20 °C, 1 bar) un risque potentiel ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- À 20 °C, 1 bar : le volume molaire des gaz est V_m = 24,0 L·mol-1.
- M(\mathrm{C})=12,0 g·mol-1;
- M(\mathrm{O})=16,0 g·mol-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Analyse de l'énoncé
1.
La combustion est une réaction avec \mathrm{O}_{2}(\mathrm{g}).
2. Il faut toujours trois lignes dans un tableau d'avancement (état initial, intermédiaire et final).
3. Compléter la dernière ligne du tableau pour trouver x_\text{max}.
4. D'après le tableau des risques, il faut déterminer le pourcentage de monoxyde de carbone dans les 100 m3 d'air.
2. Il faut toujours trois lignes dans un tableau d'avancement (état initial, intermédiaire et final).
3. Compléter la dernière ligne du tableau pour trouver x_\text{max}.
4. D'après le tableau des risques, il faut déterminer le pourcentage de monoxyde de carbone dans les 100 m3 d'air.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Solution rédigée
1. 2\: \mathrm{C}(\mathrm{s})+\mathrm{O}_{2}(\mathrm{g}) \rightarrow 2\: \mathrm{CO}(\mathrm{g})
2.

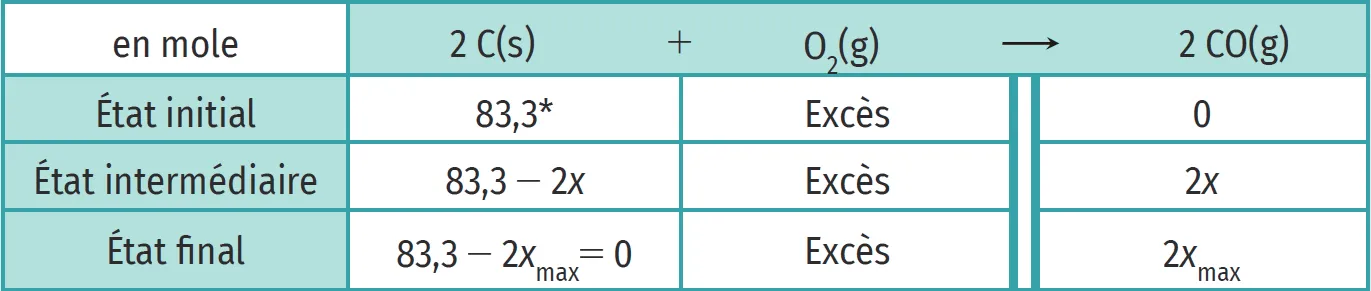
^\star : n_{0}(\mathrm{C})=\dfrac{m(\mathrm{C})}{M(\mathrm{C})}=\dfrac{1{,}00 \times 10^{3}}{12{,}0}=83\text{,}3 mol.
3. En complétant la dernière ligne du tableau (EF), on en déduit x_\text{max} = \dfrac{83{,}3}{2} = 41\text{,}7 mol. Il s'est donc formé 2x_\text{max} = 83\text{,}3 mol de \text{CO}.
4. Le volume occupé par une mole de gaz vaut 24,0 L (données).
Par conséquent, V_{\mathrm{co}}=V_{\mathrm{m}} \cdot n=24{,}0 \times 83{,}3=2{,}00 \times 10^{3} L.
Le volume d'air étant de 100 m3 = 100 \times 10^{3} L, le pourcentage de \text{CO} vaut :
2.


^\star : n_{0}(\mathrm{C})=\dfrac{m(\mathrm{C})}{M(\mathrm{C})}=\dfrac{1{,}00 \times 10^{3}}{12{,}0}=83\text{,}3 mol.
3. En complétant la dernière ligne du tableau (EF), on en déduit x_\text{max} = \dfrac{83{,}3}{2} = 41\text{,}7 mol. Il s'est donc formé 2x_\text{max} = 83\text{,}3 mol de \text{CO}.
4. Le volume occupé par une mole de gaz vaut 24,0 L (données).
Par conséquent, V_{\mathrm{co}}=V_{\mathrm{m}} \cdot n=24{,}0 \times 83{,}3=2{,}00 \times 10^{3} L.
Le volume d'air étant de 100 m3 = 100 \times 10^{3} L, le pourcentage de \text{CO} vaut :
p=\left(\dfrac{2{,}00 \times 10^{3}}{100 \times 10^{3}}\right) \times 100=2{,}00 \,\% .
Décès inévitable (> 1\text{,}28 %).
La toxicité du \bf{\mathrm{CO}_2}
À 2 % de \mathrm{CO}_2 dans l'air, l'amplitude respiratoire augmente. À 10 %, peuvent apparaître des troubles visuels, des tremblements et des sueurs. À 25 %, un arrêt respiratoire entraîne le décès.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour bien répondre
1.
Préciser l'état physique (solide, gaz) peut être utile par la suite.
2. Le dioxygène étant en excès, aucun calcul n'est nécessaire. Attention aux coefficients stœchiométriques.
3. x_\text{max} se détermine à partir du réactif limitant.
4. Le volume molaire ne s'applique qu'aux gaz.
\;\;\, Rappel : 1 m3 = 103 dm3 = 103 L.
2. Le dioxygène étant en excès, aucun calcul n'est nécessaire. Attention aux coefficients stœchiométriques.
3. x_\text{max} se détermine à partir du réactif limitant.
4. Le volume molaire ne s'applique qu'aux gaz.
\;\;\, Rappel : 1 m3 = 103 dm3 = 103 L.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
25Mise en application
1. Reprendre les questions 1., 2. et 3. dans le cas de la combustion complète (formation de dioxyde de carbone à la place du monoxyde de carbone).2. Calculer le pourcentage de dioxyde de carbone ainsi produit dans l'air. Ce gaz représente-t-il alors un danger ?
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

