Chapitre 5
Exercices
Pour s'échauffer - Pour commencer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour s'échauffer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
5Le titrage direct
Donner la définition d'un titrage direct et son intérêt.Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
6Dosage et titrage
Quelle est la différence entre dosage et titrage ?Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
7La quantité de matière
Rappeler la ou les relation(s) pour calculer une quantité de matière en précisant grandeurs et unités.Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
8L'équivalence
Donner la relation entre les quantités de matière à l'équivalence en précisant chaque grandeur et symbole.Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9Équivalence
On titre les ions fer (II) \text{Fe}^{2+} par les ions cérium (IV) \text{Ce}^{4+} selon l'équation de réaction :
\mathrm{Fe}^{2+}(\mathrm{aq})+\mathrm{Ce}^{4+}(\mathrm{aq}) \rightarrow \mathrm{Fe}^{3+}(\mathrm{aq})+\mathrm{Ce}^{3+}(\mathrm{aq})
Quelle relation existe-t-il entre les quantités de matière de \text{Fe}^{2+} et \text{Ce}^{4+} à l'équivalence ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour commencer
Dosage par titrage ou par étalonnage
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
10Réaction support de titrage
✔ RAI/MOD : Modéliser une transformation chimique
Naïma veut réaliser le titrage d'une solution de sulfate de fer (II) par une solution de permanganate de potassium.
Établir l'équation de la réaction support de titrage en justifiant la démarche.
Couples redox des espèces mises en jeu :
\mathrm{MnO}_{4}^{-}(\mathrm{aq}) / \mathrm{Mn}^{2+}(\mathrm{aq}) ;
\mathrm{Fe}^{3+}(\mathrm{aq}) / \mathrm{Fe}^{2+}(\mathrm{aq}).
Établir l'équation de la réaction support de titrage en justifiant la démarche.
Données
Couples redox des espèces mises en jeu :
Rappel
Pour établir l'équation bilan d'une réaction d'oxydoréduction il faut partir des demi-équations
électroniques.
Solution de sulfate de fer (II) : (\mathrm{SO}_{4}^{2-}(\mathrm{aq})\,;\,\mathrm{Fe}^{2+}(\mathrm{aq}))
Solution de permanganate de potassium : \operatorname{MnO}_{4}^{-}(\mathrm{aq})+\mathrm{K}^{+}(\mathrm{aq}).
Solution de sulfate de fer (II) : (\mathrm{SO}_{4}^{2-}(\mathrm{aq})\,;\,\mathrm{Fe}^{2+}(\mathrm{aq}))
Solution de permanganate de potassium : \operatorname{MnO}_{4}^{-}(\mathrm{aq})+\mathrm{K}^{+}(\mathrm{aq}).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11Schéma d'expérience
✔ APP : Faire un brouillon comprenant un schémaPour doser une solution de permanganate de potassium (\mathrm{K}^{+}(\mathrm{aq}) \,;\, \mathrm{MnO}_{4}^{-}(\mathrm{aq})), on réalise un ensemble de 10 solutions de concentration croissante. On mesure ensuite l'absorbance de ces solutions à \lambda = 540 nm. Puis on détermine la concentration de la solution en mesurant son absorbance.
1. Réaliser le schéma d'une dilution.
Cliquez pour accéder à une zone de dessin
2. Cette expérience est-elle un titrage ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Les échanges d'énergie
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
12Les ions chlorure
✔ APP : Maîtriser le vocabulaire du cours




On réalise le titrage de 25\text{,}0 mL de l'eau Minérals par une solution de nitrate
d'argent à 2\text{,}5 \times 10^{-2} mol·L-1. On ajoute 1\text{,}0 mL de chromate de potassium qui donne une teinte jaune à la solution avant l'équivalence et rouge après l'équivalence.
1. Comment repérer l'équivalence ?
2. Déterminer la concentration en ions chlorure obtenue lors du titrage.
1. Comment repérer l'équivalence ?
2. Déterminer la concentration en ions chlorure obtenue lors du titrage.

Données
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
13Titrage d'un lait
✔ APP : Extraire l'information utile sur supports variés
On réalise le titrage de l'acide lactique par l'hydroxyde de sodium. L'expérience est suivie par pH-métrie. Le volume équivalent est égal à 15,2 mL et le pH à l'équivalence est égal à 8,0.
Donner l'indicateur coloré à choisir. Justifier.
On réalise le titrage de l'acide lactique par l'hydroxyde de sodium. L'expérience est suivie par pH-métrie. Le volume équivalent est égal à 15,2 mL et le pH à l'équivalence est égal à 8,0.
Donner l'indicateur coloré à choisir. Justifier.
| Indicateur coloré | Couleur d'acide | Zone de virage pH | Couleur basique |
| Rouge de méthyle | Rouge | 4,4 \bf{-} 6,2 | Jaune |
| Bleu de thymol | Jaune | 8,0 \bf{-} 9,6 | Bleu |
| Jaune d'Alizarine | Jaune | 10,0 \bf{-} 12,0 | Rouge |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
14Dosage de l'éthanol
✔ RAI/MOD : Décrire l'état initial et l'état final d'un système
Les éthylotests fonctionnent à l'aide d'une réaction d'oxydoréduction mettant en jeu des espèces colorées. L'équation de la réaction chimique est la suivante :
De quelle couleur est le test avant de souffler dedans ? lorsque le test est positif ?
3\,\mathrm{C}_{2} \mathrm{H}_{6} \mathrm{O}(\mathrm{aq})+2\,\mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}(\mathrm{aq})+16\,\mathrm{H}^{+}(\mathrm{aq}) \rightarrow 3 \,\mathrm{C}_{2} \mathrm{H}_{4} \mathrm{O}_{2}(\mathrm{aq})+4\, \mathrm{Cr}^{3+}(\mathrm{aq})+11\, \mathrm{H}_{2} \mathrm{O}(\mathrm{l})
De quelle couleur est le test avant de souffler dedans ? lorsque le test est positif ?
Doc. 1
Les couleurs de l'éthylotest
- \mathrm{C}_{2} \mathrm{H}_{6} \mathrm{O} : incolore ;
- \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-} : orange ;
- \mathrm{Cr}^{3+} : vert ;
- \mathrm{C}_{2} \mathrm{H}_{4} \mathrm{O}_{2} : incolore.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Suivi d'une réaction chimique
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15Coefficient stœchiométrique
✔ RAI/MOD : Ajuster l'équationAjuster les équations de réaction suivantes :
a.
b.
c.
d.
e.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
16Titrage de l'eau oxygénée
✔ RAI/MOD : Décrire l'état initial et l'état final
On réalise le titrage de l'eau oxygénée par une solution de permanganate de potassium. On définit ainsi le réactif titré (eau oxygénée) et le réactif titrant (permanganate de potassium). L'équation de la réaction est la suivante :
On réalise le titrage de l'eau oxygénée par une solution de permanganate de potassium. On définit ainsi le réactif titré (eau oxygénée) et le réactif titrant (permanganate de potassium). L'équation de la réaction est la suivante :
2 \,\mathrm{MnO}_{4}^{-}(\mathrm{aq})+5 \,\mathrm{H}_{2} \mathrm{O}_{2}(\mathrm{aq})+6\, \mathrm{H}^{+}(\mathrm{aq}) \rightarrow 2\, \mathrm{Mn}^{2+}(\mathrm{aq})+5\, \mathrm{O}_{2}(\mathrm{g})+8\, \mathrm{H}_{2} \mathrm{O}(\mathrm{l})
Dans le tableau, remplacer les pointillés par les signes : \gt, \lt ou =.
| Avant équivalence | À équivalence | Après équivalence |
|
n_{0}(\mathrm{H}_{2} \mathrm{O}_{2})-5 x_{\max }\:...\: 0
|
n_{0}(\mathrm{H}_{2} \mathrm{O}_{2})-5 x_{\max } \:...\: 0
|
n_{0}(\mathrm{H}_{2} \mathrm{O}_{2})-5 x_{\max }\:...\: 0
|
|
n_{versé}(\mathrm{MnO}_{4}^{-})-2 x_{\max }\:...\: 0
|
n_{versé}(\mathrm{MnO}_{4}^{-})-2 x_{\max }\:...\: 0
|
n_{versé}(\mathrm{MnO}_{4}^{-})-2 x_{\max }\:...\: 0
|
|
5 n_{versé}(\text{MnO}_{4}^{-})\:...\: 2 n_{0}(\mathrm{H}_{2} \mathrm{O}_{2})
|
5 n_{0}(\text{MnO}_{4}^{-})\:...\: 2 n_{0}(\mathrm{H}_{2} \mathrm{O}_{2})
|
5 n_{0}(\text{MnO}_{4}^{-})\:...\: 2 n_{0}(\mathrm{H}_{2} \mathrm{O}_{2})
|
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une notion, trois exercices
Différenciation
Savoir‑faire : Suivre un titrage colorimétrique
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17Titrage des ions chlorure
✔ RAI/MOD : Déterminer une quantité de matièreLe dosage des ions chlorure \text{Cl}^{-} peut se faire par les ions argent \text{Ag}^{+}.
1. Compléter le tableau d'avancement suivant.

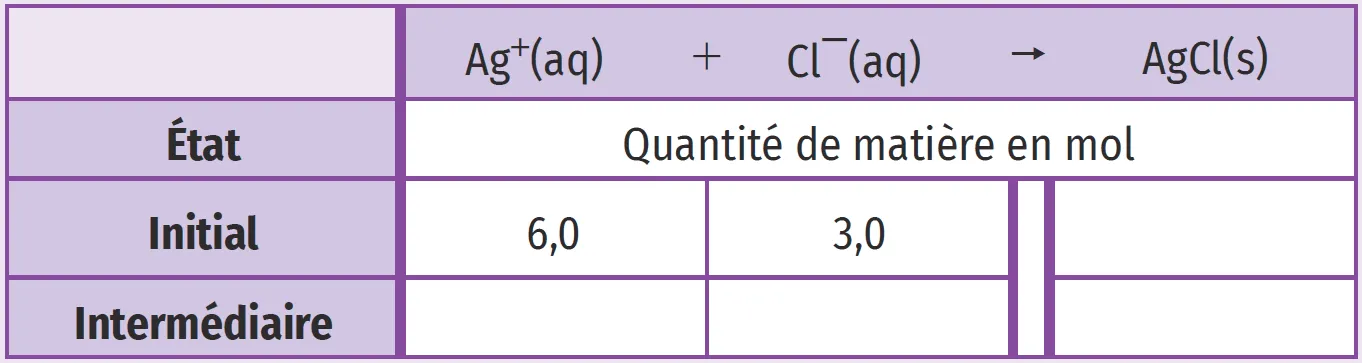
1
2
3
4
2. Est-on avant ou après équivalence ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
18Titrage des ions hydroxyde
✔ RAI/MOD : Déterminer une quantité de matièreOn cherche à titrer les ions hyrdoxyde \text{HO}^{-}(\text{aq}) d'un déboucheur de canalisation par l'acide chlorhydrique. L'équation support de la réaction est \mathrm{H}^{+}(\mathrm{aq})+\mathrm{HO}^{-}(\mathrm{aq}) \rightarrow \mathrm{H}_{2} \mathrm{O}(\mathrm{l}).
1.
Construire le tableau d'avancement avant l'équivalence.
Cliquez pour accéder à une zone de dessin
2.
Construire le tableau d'avancement après l'équivalence.
Cliquez pour accéder à une zone de dessin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
19Titrage du peroxyde d'hydrogène
✔ RAI/MOD : Déterminer une quantité de matièreOn cherche à titrer une solution d'eau oxygénée (solution aqueuse de peroxyde d'hydrogène \text{H}_{2}\text{O}_{2}) par le permanganate de potassium \mathrm{KMnO}_{4}. L'équation de la réaction support du titrage est :
5 \,\mathrm{H}_{2} \mathrm{O}_{2}(\mathrm{aq})+2\, \mathrm{MnO}_{4}^{-}(\mathrm{aq})+6\, \mathrm{H}^{+}(\mathrm{aq}) \rightarrow 2\, \mathrm{Mn}^{2+}(\mathrm{aq})+8\, \mathrm{H}_{2} \mathrm{O}(\mathrm{l})+5\, \mathrm{O}_{2}(\mathrm{g}).
1. Construire le tableau d'avancement de la réaction de l'équivalence.
Cliquez pour accéder à une zone de dessin
2. La quantité d'ions permanganate introduit à l'équivalence est n = 4\text{,}2 mol. Déterminer la quantité de peroxyde d'hydrogène titrée.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

