Chapitre 6
Exercices
Pour s'échauffer - pour commencer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
| Pour commencer | Différenciation | Pour s'entraîner | |
|---|---|---|---|
| Établir un schéma de Lewis : | |||
| Interpréter la géométrie d'une molécule à partir de son schéma de Lewis : | |||
| Déterminer le caractère polaire d'une liaison à partir de la donnée de l'électronégativité des atomes : | |||
| Déterminer le caractère polaire ou apolaire d'une entité moléculaire : |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour s'échauffer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
5 Autour du dihydrogène
Établir le schéma de Lewis de la molécule de dihydrogène \mathrm{H}_{2}. Préciser si cette molécule est polaire.Cliquez pour accéder à une zone de dessin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
6 La molécule de dioxygène
Établir le schéma de Lewis de la molécule de dioxygène \mathrm{O}_{2}. Préciser si cette molécule est polaire.Cliquez pour accéder à une zone de dessin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
7 Un ion monoatomique particulier
Établir le schéma de Lewis de l'ion \mathrm{H}^{+}.En quoi cet ion est-il particulier ?Cliquez pour accéder à une zone de dessin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
8 Schéma de Lewis de l'eau
Établir le schéma de Lewis de la molécule de l'eau.
Pourquoi faut-il connaître la géométrie de cette molécule pour déterminer si elle est polaire ou non ?Cliquez pour accéder à une zone de dessin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9 Autour du méthane
La formule chimique du méthane est \mathrm{CH}_{4}.1. Établir le schéma de Lewis de cette molécule.
Cliquez pour accéder à une zone de dessin
2. Justifier sa géométrie tétraédrique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
10 L'ion oxyde
L'ion oxyde est l'ion monoatomique issu de l'atome d'oxygène. 1. Préciser la configuration électronique de l'atome d'oxygène et en déduire celle de l'ion monoatomique stable qu'il pourrait donner.
2. Proposer la formule chimique de l'ion oxyde et établir son schéma de Lewis.
Cliquez pour accéder à une zone de dessin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11 Autour de l'ammonium
Établir le schéma de Lewis de l'ion ammonium \mathrm{NH}_{4}^{+} et justifier sa géométrie tétraédrique. Cliquez pour accéder à une zone de dessin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour commencer
Schéma de Lewis
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
12 Autour de quelques molécules simples
✔ RAI/MOD : Respecter les conventions en chimie
Déterminer la représentation de Lewis des molécules d'eau \mathrm{H}_{2} \mathrm{O}, de dioxyde de carbone \mathrm{CO}_{2} et de méthane \mathrm{CH}_{4}.
Cliquez pour accéder à une zone de dessin
Données
Numéro atomique d'éléments chimiques :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
13 Autour de l'ammoniac
✔ RAI/MOD : Respecter les conventions en chimieL'ammoniac est un gaz incolore, irritant et très odorant, il a pour formule \mathrm{NH}_{3}.La solution d'ammoniaque, quant à elle, contient des ions \mathrm{OH}^{-} et des ions \mathrm{NH}_{4}^{+}.
1.
Déterminer la représentation de Lewis de la molécule d'ammoniac.
Cliquez pour accéder à une zone de dessin
2.
Déterminer la représentation de Lewis de l'ion hydroxyde \mathrm{OH}^{-}.
Cliquez pour accéder à une zone de dessin
3.
Établir le schéma de Lewis de l'ion ammonium \mathrm{NH}_{4}^{+}.
Cliquez pour accéder à une zone de dessin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Géométrie des molécules
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
14 Les gaz de l'atmosphère
✔ APP : Maîtriser le vocabulaire du cours


1.
Établir la géométrie dans l'espace de ces deux molécules.
Cliquez pour accéder à une zone de dessin
2.
Le dioxyde de carbone \mathrm{CO}_{2} est aussi présent dans l'atmosphère ainsi que la vapeur d'eau. La molécule de \mathrm{CO}_{2} est linéaire et celle d'eau est coudée. Expliquer cette différence à l'aide des schémas de Lewis et de ces deux molécules.
Cliquez pour accéder à une zone de dessin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15 L'acide hypochloreux
✔ RAI/ANA : Construire un raisonnement
L'acide hypochloreux, de formule chimique \mathrm{HOCl}, est utilisé dans l'industrie cosmétique à faible concentration comme agent nettoyant de la peau.
Établir sa représentation de Lewis et justifier la géométrie de cette molécule.
Établir sa représentation de Lewis et justifier la géométrie de cette molécule.
Cliquez pour accéder à une zone de dessin
Informations sur la géométrie de \text{HOCl }

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Polarité des entités moléculaires
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
16 Liaison polarisée dans un organomagnésien
✔ RAI/ANA : Construire un raisonnement
Dans la molécule de bromure de butylmagnésium ci-dessus, identifier les deux liaisons polarisées. Justifier.


Données
Électronégativité \chi des atomes :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17 Solvants polaires ou apolaires
✔ RAI/ANA : Faire le lien entre un modèle microscopique et des
grandeurs macroscopiques
Le cyclohexane et le dichlorométhane sont des solvants courants en chimie organique.
Ces solvants sont-ils polaires ? Justifier la réponse.
Le cyclohexane et le dichlorométhane sont des solvants courants en chimie organique.
Ces solvants sont-ils polaires ? Justifier la réponse.
Cliquez pour accéder à une zone de dessin
Doc. 1
Dichlorométhane

Doc. 2
Cyclohexane

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une notion, trois exercices
Différenciation
Savoir-faire : Établir un schéma de Lewis
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
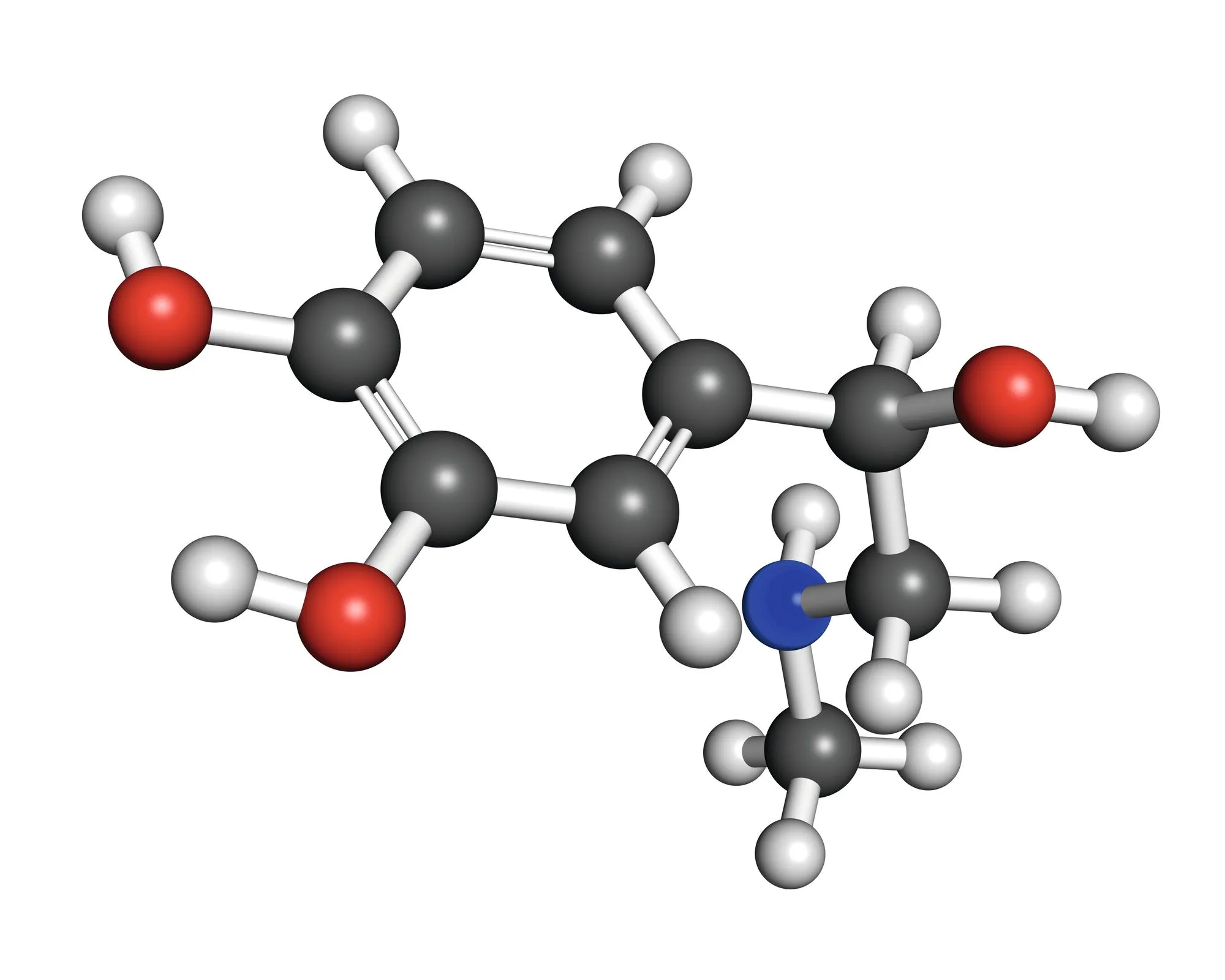
18Vers la structure de Lewis de l'adrénaline
✔ RAI/MOD : Respecter les conventions en chimie
1.
À l'aide du modèle moléculaire du document ci-dessus, établir la formule brute de la molécule d'adrénaline.
2. À partir de leurs configurations électroniques, préciser le nombre de liaisons formées par chacun des types d'atomes impliqués dans cette molécule (\mathrm{C}, \mathrm{H}, \mathrm{O} et \mathrm{N}).
2. À partir de leurs configurations électroniques, préciser le nombre de liaisons formées par chacun des types d'atomes impliqués dans cette molécule (\mathrm{C}, \mathrm{H}, \mathrm{O} et \mathrm{N}).
| Nom | Modèle | Symbole |
|---|---|---|
| Hydrogène |
 | \mathrm{H} |
| Carbone |  | \mathrm{C} |
| Azote |  | \mathrm{N} |
| Oxygène |  | \mathrm{O} |
3.
En déduire la représentation de Lewis de cette molécule.
Numéros atomiques des atomes :
\mathrm{H} (Z=1) ;
\mathrm{C} (Z=6) ;
\mathrm{N} (Z=7) ;
\mathrm{O} (Z=8).
Cliquez pour accéder à une zone de dessin
Données
Numéros atomiques des atomes :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
19 Vers la géométrie spatiale
✔ RAI/MOD : Respecter les conventions en chimie
Après avoir établi la représentation de Lewis de la molécule d'adrénaline, déterminer la géométrie spatiale adoptée par les atomes du cycle de 6 carbones. Justifier la réponse proposée.
Cliquez pour accéder à une zone de dessin
Doc. 1
Découverte de l'adrénaline
Jokichi Takamine (1854-1922), biochimiste et industriel, découvrit en 1901 la première hormone pure
jamais isolée d'une source naturelle, la glande médullo-surrénale. Il la nomma adrenalin (qui signifie près du rein).
Son modèle moléculaire est représenté ci-après :
Son modèle moléculaire est représenté ci-après :

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
20 Adrénaline ou noradrénaline
✔ RAI/MOD : Respecter les conventions en chimie
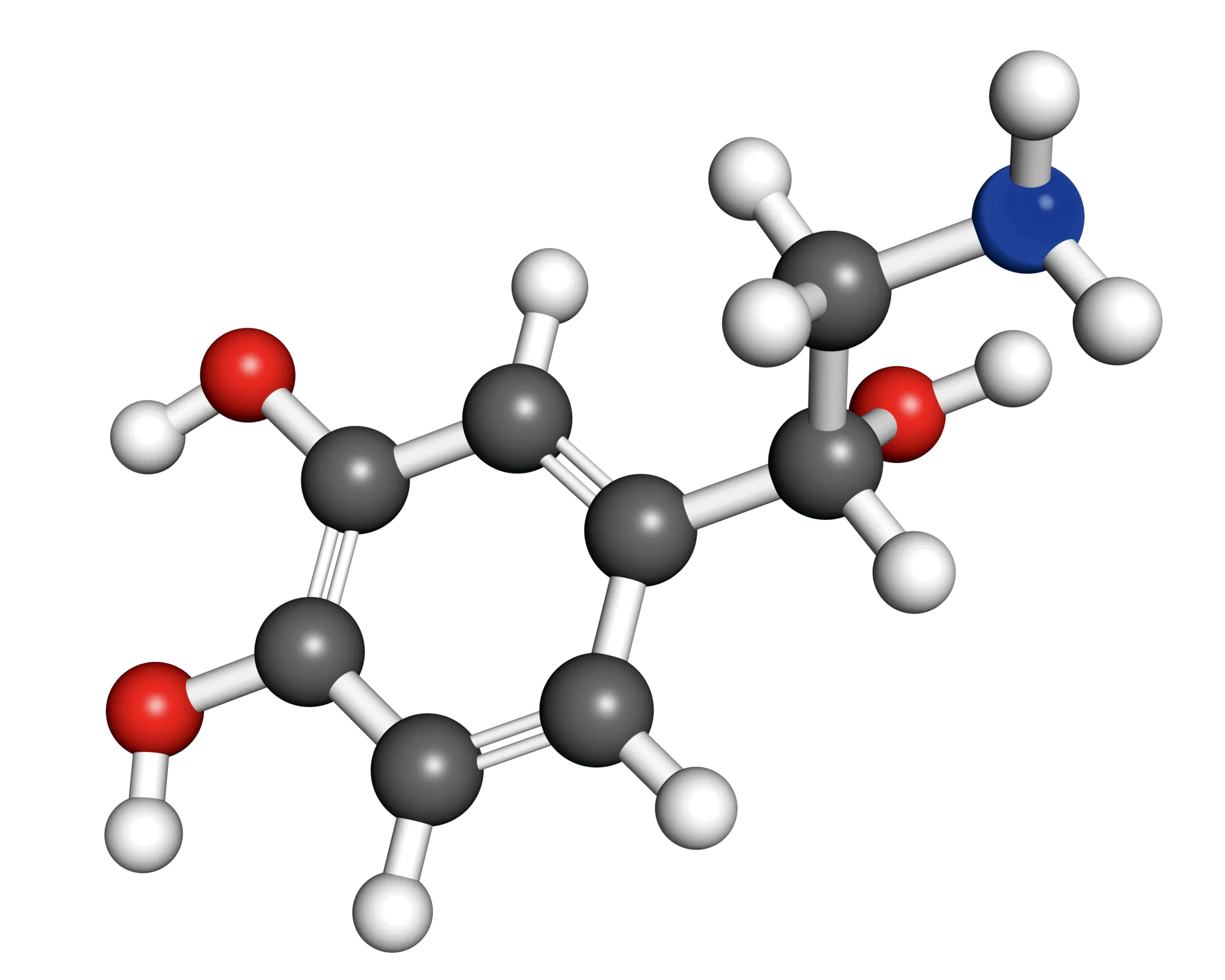
Cliquez pour accéder à une zone de dessin
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

