Chapitre 2
Exercice corrigé
Dosage des ions dichromate
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Énoncé
Compétence(s)
APP : Extraire l'information utile sur supports variés
VAL : Analyser un résultat numérique
VAL : Analyser un résultat numérique
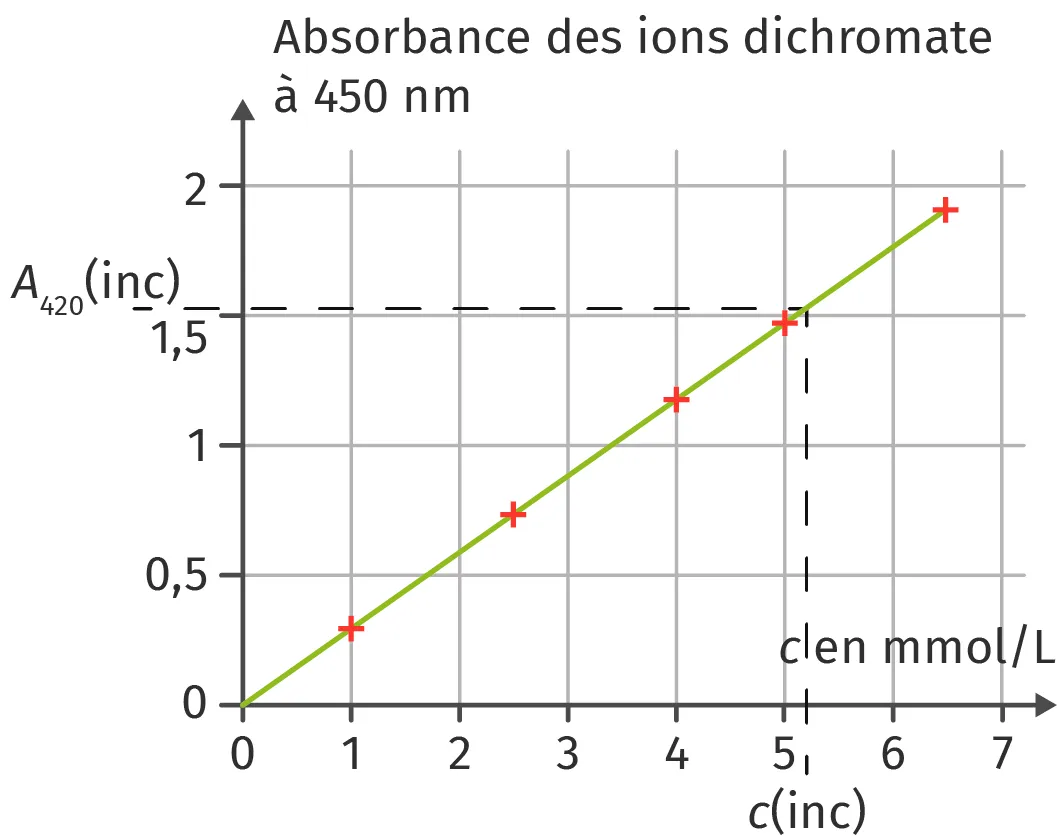
Pour doser une solution orangée contenant des ions dichromate \text{Cr}_{2}\text{O}^{2-}_{7}(\text{aq}), on réalise une gamme de solutions étalons de concentrations différentes. Le spectrophotomètre est réglé sur une longueur d'onde de 450 nm. Les cuves utilisées pour réaliser ces mesures sont d'une largeur de 1,0 cm. Les résultats sont présentés dans le tableau ci-dessous :
| Solution étalon | A | B | C | D | E |
| Concentration \bf{c} (mmol⋅L-1) | 6,5 | 5,0 | 4,0 | 2,5 | 1,0 |
| Absorbance à 450 nm \bf{A_{450}} | 1,9 | 1,46 | 1,25 | 0,73 | 0,29 |
1. Justifier le réglage du spectrophotomètre à 450 nm.
2. Tracer la courbe d'étalonnage A_{450} = f(c). La loi de Beer-Lambert est-elle vérifiée ?
Cliquez pour accéder à une zone de dessin
3. L'absorbance A_{450,\:\text{inc}} d'une solution de concentration inconnue en ions dichromate est mesurée avec le même spectrophotomètre et les mêmes réglages. La valeur est A_{450,\:\text{inc}} = 1,52. En déduire la valeur de la concentration c_{\text { inc}}.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Analyse de l'énoncé
1.
Mettre en relation le réglage du spectrophotomètre avec la couleur de la solution.
2. Repérer dans le tableau les grandeurs à porter en abscisses et en ordonnées. Écrire la loi de Beer-Lambert.
3. Utiliser la droite d'étalonnage pour déterminer la concentration d'une solution.
2. Repérer dans le tableau les grandeurs à porter en abscisses et en ordonnées. Écrire la loi de Beer-Lambert.
3. Utiliser la droite d'étalonnage pour déterminer la concentration d'une solution.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour bien répondre
1.
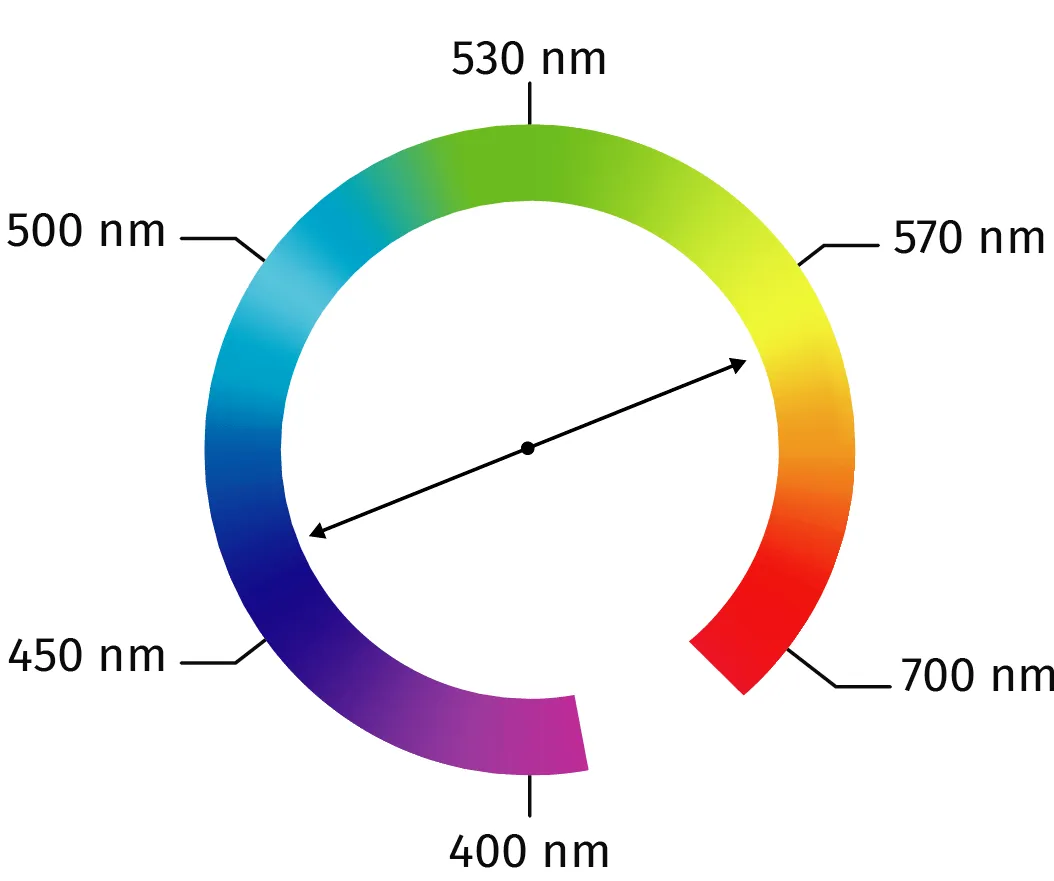
Utiliser le cercle chromatique (doc. 1) pour déterminer la couleur absorbée.
2. Choisir une échelle adaptée aux valeurs.
3. Déterminer l'abscisse du point de la droite dont l'ordonnée est A_{450,\:\text{inc}} = 1,52.
2. Choisir une échelle adaptée aux valeurs.
3. Déterminer l'abscisse du point de la droite dont l'ordonnée est A_{450,\:\text{inc}} = 1,52.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1
Cercle chromatique simplifié

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Solution rédigée
1. La couleur d'une solution est la couleur complémentaire des
radiations absorbées par la solution, c'est-à-dire la couleur diamétralement opposée sur le cercle chromatique. La solution est perçue de couleur jaune, c'est donc qu'elle absorbe les radiations
bleues (450-500 nm).
2. Les points sont alignés. La courbe d'étalonnage est une droite passant par l'origine. A et c sont proportionnelles : l'équation de la droite d'étalonnage est de la forme A = \text{k} · c. La loi de Beer-Lambert est bien vérifiée.
3. Par lecture graphique, la valeur de la concentration en ions dichromate de la solution inconnue dont l'absorbance est A_{450,\:\text{inc}} = 1,52 est : c_\text{ inc} = 5,2 mmol⋅L-1.
2. Les points sont alignés. La courbe d'étalonnage est une droite passant par l'origine. A et c sont proportionnelles : l'équation de la droite d'étalonnage est de la forme A = \text{k} · c. La loi de Beer-Lambert est bien vérifiée.
3. Par lecture graphique, la valeur de la concentration en ions dichromate de la solution inconnue dont l'absorbance est A_{450,\:\text{inc}} = 1,52 est : c_\text{ inc} = 5,2 mmol⋅L-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15Mise en application
1. Tracer la droite d'étalonnage pour les valeurs de concentration c d'ions permanganate données dans le tableau ci-dessous.
| Solution étalon | A | B | C | D | E |
| Concentration \bf{c} (mmol⋅L-1) | 0,05 | 0,10 | 0,15 | 0,20 | 0,25 |
| Absorbance \bf{A_{540}} | 0,07 | 0,13 | 0,20 | 0,26 | 0,33 |
2. Déterminer la valeur de la concentration c_\text{ inc} de la solution dont l'absorbance mesurée est A_{540,\:\text{inc}} = 0,21.
3. Pour une cuve de largeur de 1,0 cm, déterminer la valeur du coefficient d'extinction molaire \epsilon_{540}.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

