Chapitre 2
Exercices
Pour s'entraîner
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
16Dosage par étalonnage
✔ VAL : Exploiter un ensemble de mesuresOn réalise le dosage spectrophotométrique d'une solution aqueuse de diiode \text{I}_{2}. Les mesures de l'absorbance à 520 nm pour plusieurs solutions étalons sont données dans le tableau ci-dessous.
| Solution étalon | A | B | C | D | E |
| Concentration \bf{c} (mmol⋅L-1) | 0,20 | 0,30 | 0,40 | 0,50 | 0,60 |
| Absorbance \bf{A_{520}} | 0,16 | 0,24 | 0,32 | 0,40 | 0,48 |
1. Tracer la droite d'étalonnage.
2. Déterminer la concentration en quantité de matière d'une solution de diiode de concentration inconnue dont la mesure de l'absorbance à 520 nm est A_{520} = 0,31.
3. Déterminer la valeur du coefficient d'extinction molaire du diiode sachant que la cuve de mesure a une largeur de 1,0 cm.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17Validité de la loi de Beer-Lambert
✔ VAL : Identifier des sources d'erreurs✔ RAI/ANA : Élaborer un protocole
Rayan décide de vérifier la loi de Beer-Lambert pour des solutions contenant l'ion permanganate. Pour ce faire, il réalise une série d'expériences : il dispose de tout le matériel de laboratoire nécessaire et du spectre d'absorption de l'ion permanganate ci-dessous pour réaliser ses expériences.

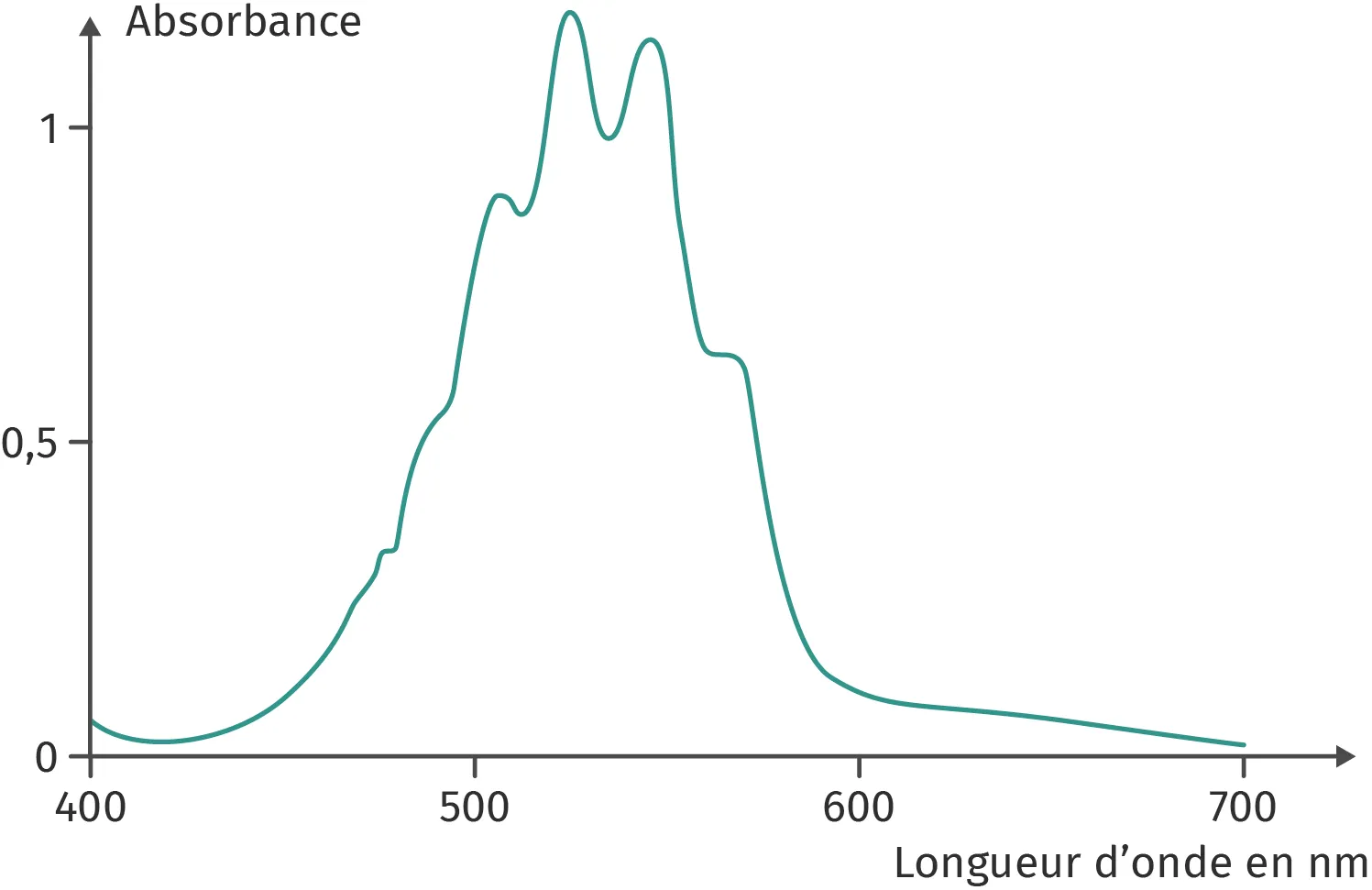
Expérience 1
Droite d'étalonnageIl réalise une série de cinq solutions étalons dont les concentrations sont comprises entre 0,01 mmol⋅L-1 et 0,05 mmol⋅L-1. Il règle le spectrophotomètre à 600 nm et effectue ses mesures. Après avoir saisi ses résultats dans un tableur, il trace la courbe d'étalonnage et remarque que les points ne sont pas alignés. Il modélise la droite mais celle-ci ne passe pas par l'origine.
1. Identifier dans le protocole de Rayan ce qui ne lui permet pas de vérifier la relation de proportionnalité entre l'absorbance et la concentration d'une solution diluée contenant l'ion permanganate.
Expérience 2
Additivité des absorbancesRayan dispose de deux solutions : la solution 1 de permanganate de potassium et la solution 2 incolore qui
contient des ions fer (II). Il mesure l'absorbance de la solution 1 et trouve A_{1} = 0,25. Il mélange deux volumes V égaux de chaque solution pour ensuite mesurer l'absorbance du mélange et ainsi vérifier l'additivité de l'absorbance. Cependant, il découvre que le mélange est devenu
incolore.
2. Formuler une hypothèse permettant d'expliquer le résultat de l'expérience.
3. Proposer un autre protocole expérimental permettant de vérifier l'additivité des absorbances pour une solution diluée colorée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
18
Copie d'élève à commenter
Proposer une justification pour chaque erreur relevée par le correcteur.Diagnostic du diabète
Selon l'Organisation mondiale de la santé (OMS) un patient est diabétique quand sa glycémie à jeun est
supérieure au moins à deux reprises à 7 mmol·L-1.
Données
- Masses molaires en g·mol-1 :
M(\text{C})=12\text{,}0 ;
M(\text{O})=16\text{,}0 ;
M(\mathrm{H})=1\text{,}0.
1.
La concentration en masse de glucose est donnée par \color{red}\xcancel{\color{black}\dfrac{{masse\:glucose }}{{volume\:glucose }}} donc :
prise 1 : \gamma_{1}=\dfrac{9\text{,}0}{5}=1\text{,}8 g·L-1
prise 2 : \gamma_{2}=\dfrac{8\text{,}6}{5}=1\text{,}7 g·L-1
prise 1 : \gamma_{1}=\dfrac{9\text{,}0}{5}=1\text{,}8 g·L-1
prise 2 : \gamma_{2}=\dfrac{8\text{,}6}{5}=1\text{,}7 g·L-1
2.
Pour calculer la concentration en quantité de matière de glucose, j'ai besoin de la masse molaire :
M\left(C_{6} H_{12} O_{6}\right)=6 M(C)+12 M(H)+6 M(O)=180\text{,}0 g·mol -1
La concentration en quantité de matière de glucose est obtenue en divisant par la masse molaire car n=\dfrac{m}{M} :
\color{red}\xcancel{\color{black}c_{1}=\dfrac{1\text{,}8}{108}=0\text{,}017} mol·L-1
c_{2}=\dfrac{1\text{,}7}{180}=0\text{,}009\,4 mol·L-1
3.Il ne faut pas que la concentration dépasse 7. Or on a 0,017 et 0,009 4, il n'y a pas de
problème le patient n'est pas diabétique.
M\left(C_{6} H_{12} O_{6}\right)=6 M(C)+12 M(H)+6 M(O)=180\text{,}0 g·mol -1
La concentration en quantité de matière de glucose est obtenue en divisant par la masse molaire car n=\dfrac{m}{M} :
\color{red}\xcancel{\color{black}c_{1}=\dfrac{1\text{,}8}{108}=0\text{,}017} mol·L-1
c_{2}=\dfrac{1\text{,}7}{180}=0\text{,}009\,4 mol·L-1
3.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
19Dopage au salbutamol
✔ RAI/ANA : Utiliser des mesures pour répondre à une
problématique
Le salbutamol est une molécule que l'on trouve en particulier dans la Ventoline pour le traitement de
l'asthme. Sa formule chimique est \text{C}_{13}\text{H}_{21}\text{NO}_{3}. Chez les sportifs, il améliore la ventilation et permet une meilleure résistance à l'effort. Christopher Froome, par exemple, est un cycliste asthmatique qui a été soupçonné d'utilisation excessive de son médicament. Son usage est donc réglementé et sa concentration en masse ne doit pas dépasser 1,0 mg·L-1 lors d'une
analyse d'urine. Pour Christopher Froome, on a trouvé une valeur de 3,35 μmol·L-1.


1.
Calculer la masse molaire du salbutamol.
2. En déduire la concentration \gamma en masse de salbutamol donnée par l'analyse de l'urine.
3. Christopher Froome risque-t-il une sanction ?
2. En déduire la concentration \gamma en masse de salbutamol donnée par l'analyse de l'urine.
3. Christopher Froome risque-t-il une sanction ?
Détails du barème
TOTAL /4 pts
0,5 pt
1.
Identifier les masses molaires atomiques dans le tableau périodique.0,5 pt
1.
Calculer la masse molaire moléculaire à partir de la formule brute.1 pt
2.
Convertir correctement la concentration trouvée en mol·L-1 (ou méthode équivalente).0,5 pt
2.
Utiliser la relation entre la masse, la masse molaire et la quantité de matière.1 pt
3.
Convertir la concentration en masse en mg·L-1.0,5 pt
3.
Conclure en comparant les valeurs.Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
20
La qualité de l'air en QCM
✔ MATH : Effectuer des calculs numériquesLes normes concernant la qualité de l'air indiquent que le taux moyen annuel de dioxyde d'azote \text{NO}_{2} ne doit pas dépasser 40,0 μg·m-3 d'air.
Données
- 1m3 = 103 L.
1. Une mesure dans un prélèvement d'air de 300 L donne une quantité de matière de 0,760 μmol de\text{NO}_{2}. La concentration \gamma en μg.m^{-3} correspondante est de :
2. Peut-on affirmer que la norme est dépassée ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21Hyperuricémie
✔ MATH : Effectuer des calculs numériquesL'hyperuricémie est une augmentation de la concentration de l'acide urique \text{C}_{5}\text{H}_{4}\text{N}_{4}\text{O}_{3} dans le sang. La concentration normale chez l'homme doit être située entre 206 μmol·L-1 et 441 μmol·L-1. Un excès de cette molécule peut entraîner la goutte (maladie inflammatoire des articulations) ou des calculs rénaux.
1. Calculer la masse molaire de l'acide urique.
2. Exprimer les concentrations précédentes en mg·L-1.
3. Un patient se plaint de douleurs au niveau des reins et une analyse de sang donne une valeur de 82,7 mg·L-1 d'acide urique dans le sang. Cela est-il de nature à confirmer un diagnostic de calcul rénal ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22L'axolotl
✔ MATH : Effectuer des calculs numériques

Axolotls dans un aquarium.
L'axolotl est un amphibien qui peut être atteint de mycoses. Ces mycoses peuvent être traitées par des bains intensifs de solution aqueuse de chlorure de sodium \text{ Na}\text{Cl}. D'environ 20 minutes par jour et d'une concentration en masse de 21,6 g·L-1 en chlorure de sodium dissous, ces bains (qui doivent être vidés à chaque fois) peuvent être prolongés pendant trois jours maximum.
1.
Calculer la concentration c en quantité de matière du chlorure de sodium dans ce bain.
2.
Quelle quantité de matière totale de chlorure de sodium est nécessaire pour effectuer les trois jours
de traitement dans un bac de 8,5 litres ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23Un dosage de protéines particulier
✔ VAL : Exploiter un ensemble de mesuresL'expérience est réalisée à 595 nm (couleur bleue) en présence de bleu de Coomassie. Comme pour tout dosage par spectrométrie, il faut au préalable effectuer un étalonnage. On prépare 5 tubes contenant des masses croissantes de protéines et on mesure l'absorbance à 595 nm.
| Masses (μg) | 0 | 2 | 4 | 6 | 8 |
| Absorbance | 0,10 | 0,33 | 0,57 | 0,81 | 1,09 |
1. Tracer la courbe d'étalonnage de l'absorbance en fonction de la masse.
2. L'absorbance de la solution étudiée est de 0,63. À quelle masse de protéines cela correspond-il ?
3. Sachant que le volume prélevé de solution étudiée est de 10,0 μL, en déduire la concentration \gamma en masse de protéine exprimée en g·L -1.
Méthode de Bradford
En biochimie, la méthode de Bradford est une méthode d'analyse spectroscopique utilisée pour mesurer la
concentration des protéines en solution.
D'après « Méthode de Bradford », wikipedia.org.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24
BacL'acide chlorhydrique : un puissant
décapant
✔ RÉA : Mettre en oeuvre les étapes d'une démarcheUne solution d'acide chlorhydrique est obtenue par dissolution de chlorure d'hydrogène gazeux \text{HCl} (g) dans l'eau.
1. Que signifient les pictogrammes sur la bouteille
d'acide chlorhydrique ?
2. Quelles précautions faut-il prendre lors de l'utilisation de cette espèce chimique ?
3. Calculer la masse de chlorure d'hydrogène \text{HCl} gazeux dissous dans l'eau pour obtenir cette solution du commerce.
4. Calculer la concentration c en masse en g·L-1 d'acide chlorhydrique dans cette solution du commerce.
5. Calculer la masse molaire moléculaire du chlorure d'hydrogène.
6. Calculer la concentration c_{1} en mol·L-1 de l'acide chlorhydrique du commerce.
7. Calculer le volume de solution du commerce à prélever pour préparer 500,0 mL de solution fille diluée.
8. Calculer la quantité de matière d'acide chlorhydrique dans la solution fille.
9. Calculer la concentration c_{2} en quantité de matière d'acide chlorhydrique de la solution fille.
2. Quelles précautions faut-il prendre lors de l'utilisation de cette espèce chimique ?
3. Calculer la masse de chlorure d'hydrogène \text{HCl} gazeux dissous dans l'eau pour obtenir cette solution du commerce.
4. Calculer la concentration c en masse en g·L-1 d'acide chlorhydrique dans cette solution du commerce.
5. Calculer la masse molaire moléculaire du chlorure d'hydrogène.
6. Calculer la concentration c_{1} en mol·L-1 de l'acide chlorhydrique du commerce.
7. Calculer le volume de solution du commerce à prélever pour préparer 500,0 mL de solution fille diluée.
8. Calculer la quantité de matière d'acide chlorhydrique dans la solution fille.
9. Calculer la concentration c_{2} en quantité de matière d'acide chlorhydrique de la solution fille.
Doc. 1
Acide chlorhydrique commercial
IMPORTANT : s'utilise en dilution 30 % d'acide pour 70 % d'eau : attention de toujours verser
l'acide dans l'eau. Après traitement, rincer abondamment.

DÉTARTRANT : rénovation extérieure de certaines pierres de terrasses et cuivres oxydés. Débouche, détartre les canalisations PVC.

DÉCAPANT : carrelages (traces de ciment, égalisation de joints), verre, sanitaires, ustensiles non alimentaires en fer, acier. Polit et nettoie les métaux.
Volume : 1,0 L. Acide Chlorhydrique 23 % (23 g d'acide dans 100 g de solution). Masse volumique : \rho = 1,15 g·cm-3.

DÉTARTRANT : rénovation extérieure de certaines pierres de terrasses et cuivres oxydés. Débouche, détartre les canalisations PVC.

DÉCAPANT : carrelages (traces de ciment, égalisation de joints), verre, sanitaires, ustensiles non alimentaires en fer, acier. Polit et nettoie les métaux.
Volume : 1,0 L. Acide Chlorhydrique 23 % (23 g d'acide dans 100 g de solution). Masse volumique : \rho = 1,15 g·cm-3.
Doc. 2
Nettoyage de métal à l'acide chlorhydrique


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
25Échelle de teintes
✔ VAL : Effectuer une analyse comparative
On dispose d'une solution de diiode dont on ne connaît pas la concentration et d'une autre de concentration en quantité de matière de diiode connue à 2,00 \times 10-2 mol·L-1. À l'aide d'une pipette jaugée, on prélève 2,0 mL de la solution de diiode dont la concentration est connue qu'on verse dans une fiole jaugée de 20,0 mL et on complète avec de l'eau distillée. On réalise cette opération avec des volumes de 4,0, 6,0 et 8,0 mL de diiode. On verse ces
solutions dans quatre tubes à essai.
1. Calculer les concentrations en quantité de matière de diiode dans les quatre premiers tubes.
La solution de concentration à déterminer est trop concentrée, sa couleur ne correspond pas aux tubes test. À l'aide d'une pipette jaugée, on prélève 10,0 mL de la solution inconnue que l'on verse dans une fiole jaugée de 25,0 mL. On ajoute de l'eau distillée jusqu'au trait de jauge. On verse la solution obtenue dans le 5e tube à essai.
1. Calculer les concentrations en quantité de matière de diiode dans les quatre premiers tubes.
La solution de concentration à déterminer est trop concentrée, sa couleur ne correspond pas aux tubes test. À l'aide d'une pipette jaugée, on prélève 10,0 mL de la solution inconnue que l'on verse dans une fiole jaugée de 25,0 mL. On ajoute de l'eau distillée jusqu'au trait de jauge. On verse la solution obtenue dans le 5e tube à essai.
2.
Par comparaison de couleurs, estimer la concentration c en mol·L-1 de diiode dans le 5e tube.
3. En déduire alors la concentration en diiode dans la solution initiale.


3. En déduire alors la concentration en diiode dans la solution initiale.
Doc. 3
Échelle de teintes du diiode et solution inconnue


Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

