Chapitre 2
Exercices
Pour aller plus loin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
26
BacCasse ferrique du vin
✔ APP : Formuler le résultat attendu
La casse ferrique est un dépôt qui se forme suite à une présence trop importante d'ions fer (III) \text{Fe}^{3+} dans un vin. Initialement présents sous forme d'ions fer (II) \text{Fe}^{2+}, une oxydation peut transformer ces ions fer (II) en ions fer (III).
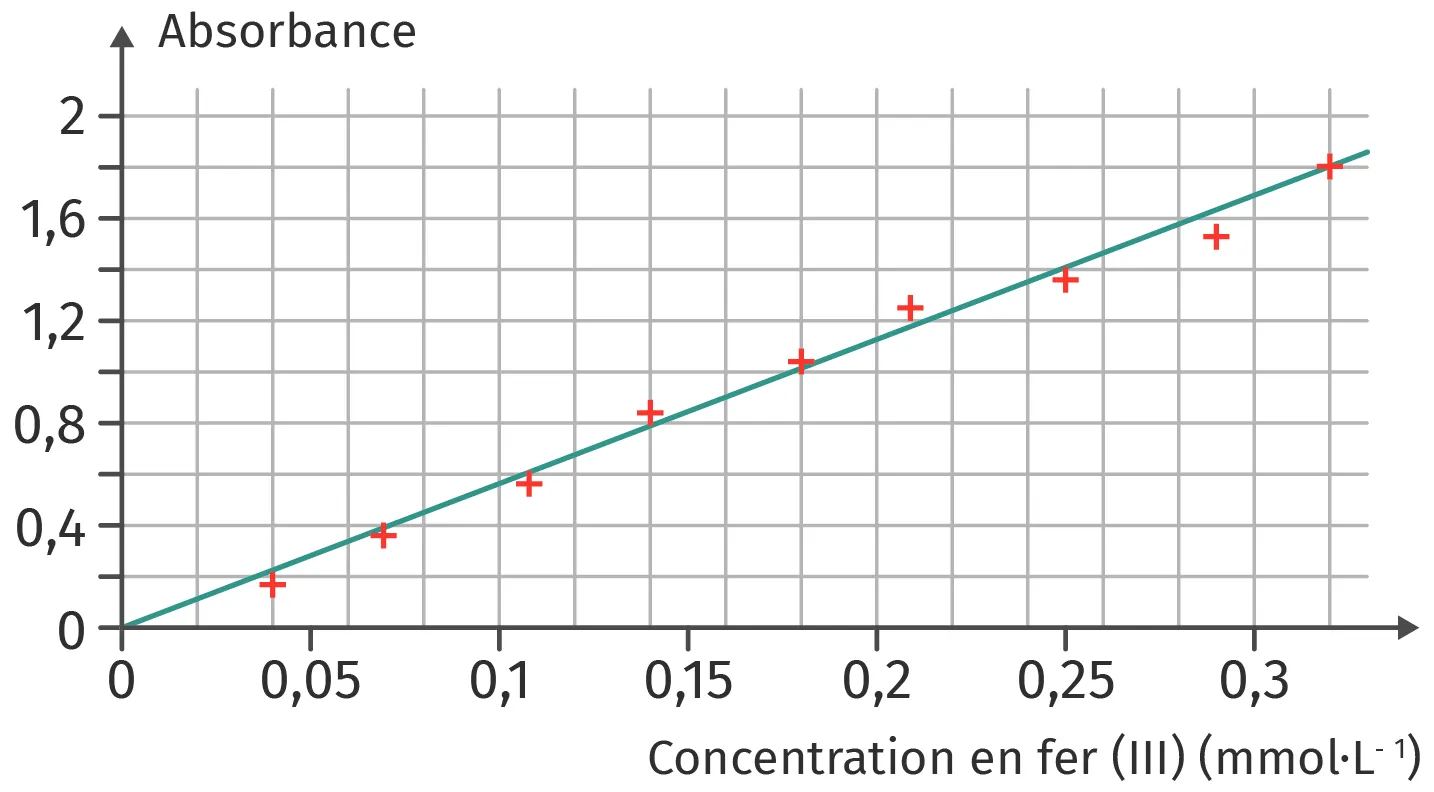
Un dosage fréquent permet de contrôler l'évolution de la concentration en ions fer (III) dans le vin. Le dosage est effectué par spectrophotométrie. La courbe de dosage est donnée dans le doc. 1.


Un dosage fréquent permet de contrôler l'évolution de la concentration en ions fer (III) dans le vin. Le dosage est effectué par spectrophotométrie. La courbe de dosage est donnée dans le doc. 1.


1. L'absorbance mesurée est égale à 0,90. Déterminer la concentration c en mol·L-1 de l'ion fer (III) dans le vin testé.
2. En déduire la concentration \gamma en masse en ions fer (III) dans ce vin.
3. Les risques de casse ferrique deviennent importants à partir de 10 mg·L-1. Ce vin doit-il être surveillé ?

2. En déduire la concentration \gamma en masse en ions fer (III) dans ce vin.
3. Les risques de casse ferrique deviennent importants à partir de 10 mg·L-1. Ce vin doit-il être surveillé ?
Doc. 1
Courbe d'étalonnage du dosage des ions fer (III)


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
27Le Ramet Dalibour
✔ RÉA : Effectuer des calculs numériques
La préparation de Ramet Dalibour permet de nettoyer des lésions de la peau pouvant éventuellement se surinfecter. Cette solution, à base de sulfate de cuivre (II) et de sulfate de zinc (II), s'utilise comme un savon liquide, pur ou dilué deux fois, suivi d'un rinçage abondant. On l'achète par flacon de 100 mL. Sur l'étiquette, on trouve les informations suivantes :
1. Calculer la concentration c en mol·L-1 de sulfate de cuivre (II) et de sulfate de zinc (II) dans le flacon.
- sulfate de cuivre (II) \text{CuSO}_{4} : 0,100 g ;
- sulfate de zinc (II) \text{ZnSO}_{4} : 0,350 g.
1. Calculer la concentration c en mol·L-1 de sulfate de cuivre (II) et de sulfate de zinc (II) dans le flacon.
2.
Détailler le protocole permettant de préparer avec précision 20,0 mL de solution diluée de Ramet Dalibour.
3. Calculer les nouvelles concentrations molaires en sulfate de cuivre (II) et en sulfate de zinc (III) dans la solution fille.
3. Calculer les nouvelles concentrations molaires en sulfate de cuivre (II) et en sulfate de zinc (III) dans la solution fille.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
28Thé ou café ?
✔ RAI/MOD : La quantité de matière
Contrairement aux idées reçues, la théine, la molécule à effets excitants du thé, et la caféine sont une seule
et même molécule. Cette molécule, c'est la 1,3,7-triméthylxanthine, de formule chimique \text{C}_{8}\text{H}_{10}\text{N}_{4}\text{O}_{2}.
La dose journalière admissible (DJA) de la caféine pour les adolescents est de 1,55 \times 10-5 mol par kg de masse corporelle. Au-delà de cette valeur, il y a des risques pour la santé. L'excès de caféine peut augmenter la nervosité et favoriser les insomnies.
La dose journalière admissible (DJA) de la caféine pour les adolescents est de 1,55 \times 10-5 mol par kg de masse corporelle. Au-delà de cette valeur, il y a des risques pour la santé. L'excès de caféine peut augmenter la nervosité et favoriser les insomnies.
| Boisson | Masse de caféine (mg) | Volume (en mL) |
| Expresso | 63 | 50 |
| Thé darjeeling | 58 | 200 |
| Cola | 40 | 330 |
| Boisson énergisante | 80 | 250 |
1.
Calculer la masse molaire moléculaire de la caféine.
2. Calculer la quantité de matière de caféine dans chacune de ces boissons.
3. Calculer la concentration en quantité de matière de caféine de ces quatre boissons.
2. Calculer la quantité de matière de caféine dans chacune de ces boissons.
3. Calculer la concentration en quantité de matière de caféine de ces quatre boissons.
4.
Déterminer la DJA en mg/kg de caféine.
5. Marlène, 16 ans, a une masse de 50 kg. Elle boit un thé tous les matins, une canette de Cola en mangeant à chaque repas et une boisson énergisante à la sortie du lycée. Prend-elle des risques pour sa santé ?
5. Marlène, 16 ans, a une masse de 50 kg. Elle boit un thé tous les matins, une canette de Cola en mangeant à chaque repas et une boisson énergisante à la sortie du lycée. Prend-elle des risques pour sa santé ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
29Mélange de solutions
✔ RAI/ANA : Proposer une stratégie de résolutionL'aide-laboratoire d'un lycée récupère les solutions qui ont servi aux élèves pour faire les tests d'identification des ions. Il reste 200 mL de solution mère d'hydroxyde de sodium à la concentration c_{\text{mère}} = 1,00 mol·L-1 mélangé à 500 mL de solution fille d'hydroxyde de sodium à la concentration c_{\text{fille}} = 1,00 \times 10-1 mol·L-1.
Il doit préparer de nouveau 1,00 L de solution mère pour un prochain TP à partir des solutions restantes.
Calculer la masse de pastilles de soude qu'il devra ajouter dans le mélange avant de compléter avec de l'eau distillée pour arriver à 1,00 L de solution.
Données
Une solution d'hydroxyde de sodium


est obtenue par dissolution de pastilles de soude \text{NaOH} dans de l'eau.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CPréparation de solutions
✔ RÉA : Effectuer des calculs numériques
À l'aide de pastilles de soude \text{NaOH}, on veut préparer 1,50 L d'une solution aqueuse d'hydroxyde de sodium à 1,00 mol·L-1 qui servira de solution mère.
1. Décrire le protocole permettant de préparer la solution mère, préciser le matériel utilisé.
2. En indiquant vos calculs, décrire le protocole permettant de préparer une solution fille de 200,0 mL à 5,00 \times 10^{-2} mol·L-1.
À l'aide de pastilles de soude \text{NaOH}, on veut préparer 1,50 L d'une solution aqueuse d'hydroxyde de sodium à 1,00 mol·L-1 qui servira de solution mère.
1. Décrire le protocole permettant de préparer la solution mère, préciser le matériel utilisé.
2. En indiquant vos calculs, décrire le protocole permettant de préparer une solution fille de 200,0 mL à 5,00 \times 10^{-2} mol·L-1.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

