Chapitre 8
Exercices
Pour s'entraîner
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17Trop ou pas assez de liaisons ?
✔ APP : Maîtriser le vocabulaire du cours
Inès aide son petit frère Camille à écrire les formules semi-développées de molécules. Les molécules représentées par Camille sont données ci-dessous.

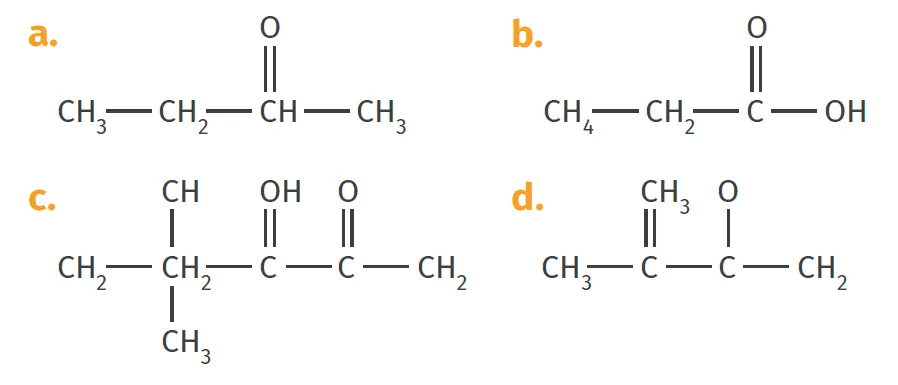 1.
Donner la structure électronique des atomes de carbone, d'hydrogène et d'oxygène.
1.
Donner la structure électronique des atomes de carbone, d'hydrogène et d'oxygène.


2.
Combien de liaisons doivent faire les atomes de carbone, d'oxygène et d'hydrogène pour être stables ? Justifier.
3. Aider Inès à corriger les formules semi-développées, ci-dessous, de Camille en justifiant.

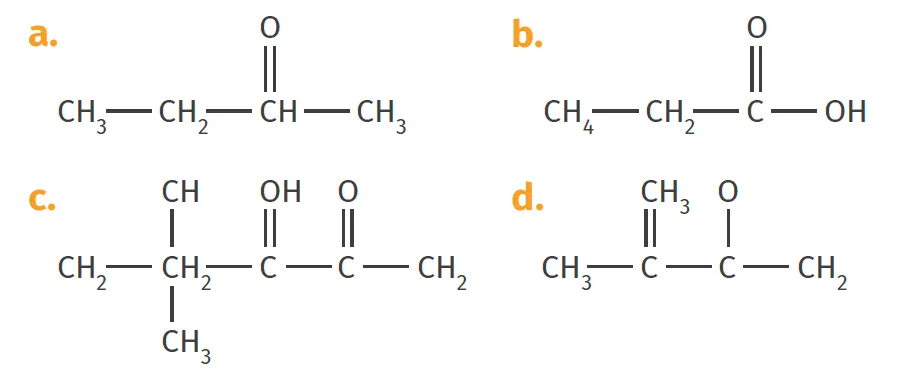
3. Aider Inès à corriger les formules semi-développées, ci-dessous, de Camille en justifiant.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
18Formule d'un alcane inconnu
✔ APP : Maîtriser le vocabulaire du coursOn cherche à représenter un alcane A qui a pour masse molaire M(A) = 58 g·mol-1.
1.
Donner la formule brute générale d'un alcane.
2. Déterminer la formule brute de cet alcane. Justifier.
3. Représenter les deux formules semi-développées possibles de cet alcane.
4. Donner le nom des deux alcanes possibles.
2. Déterminer la formule brute de cet alcane. Justifier.
3. Représenter les deux formules semi-développées possibles de cet alcane.
Cliquez pour accéder à une zone de dessin
4. Donner le nom des deux alcanes possibles.
Infos
Un hydrocarbure est un composé organique constitué seulement d'atomes de carbone et d'hydrogène. Les alcanes sont donc des hydrocarbures. Ce sont les composants principaux du pétrole.
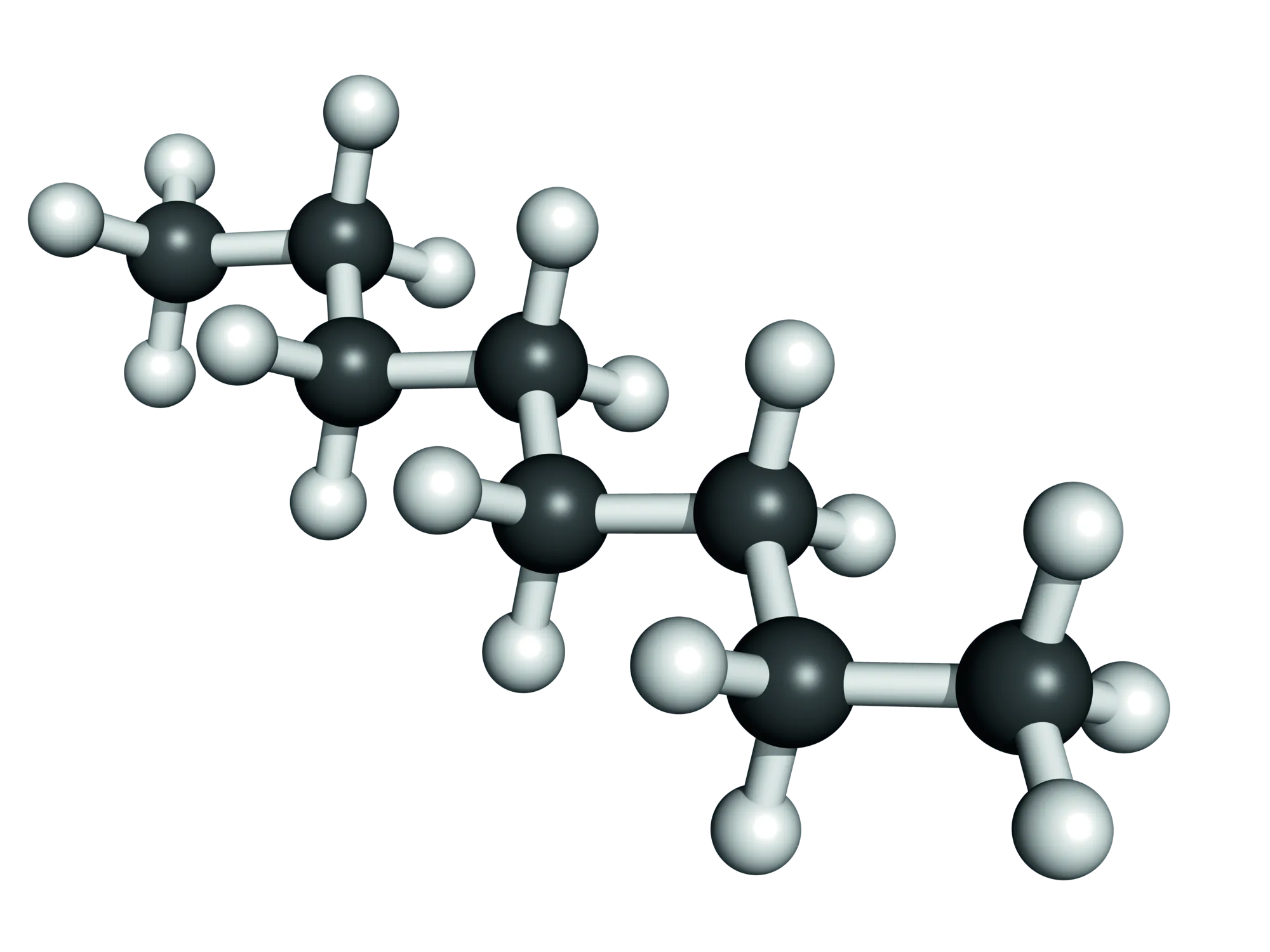
L'octane
L'octane \text{C}_8\text{H}_{18} est un des hydrocarbures présents dans le pétrole.



Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
19La molécule de vanilline
✔ APP : Maîtriser le vocabulaire du cours
Dire si ces propositions sont vraies ou fausses et justifier.

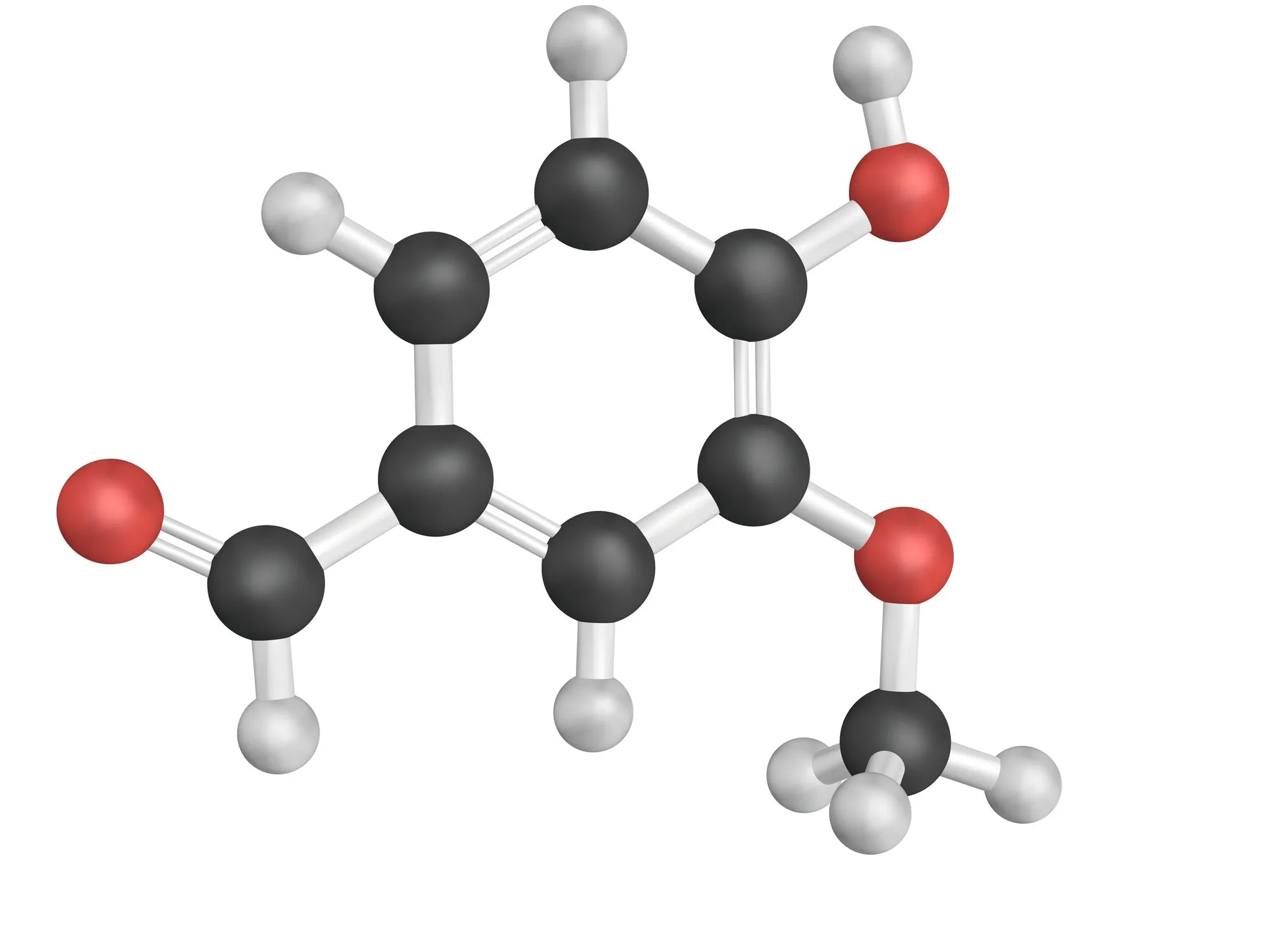
a. La vanilline a une fonction cétone.
b. La molécule est cyclique.
b. La molécule est cyclique.
c. On observe une bande large vers 3 500 cm-1 sur son spectre IR.
d. La formule brute de cette molécule est \text{C}_{8}\text{H}_{12}\text{O}_3.
d. La formule brute de cette molécule est \text{C}_{8}\text{H}_{12}\text{O}_3.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
20 Comprendre les attendus Synthèse de l'ibuprofène
✔ APP : Extraire l'information utile sur des supports variés
Gabriel réalise la synthèse de l'ibuprofène, molécule qui a des propriétés anti-infl ammatoires. Il souhaite obtenir l'ibuprofène à partir de la molécule d'isobutylbenzène.

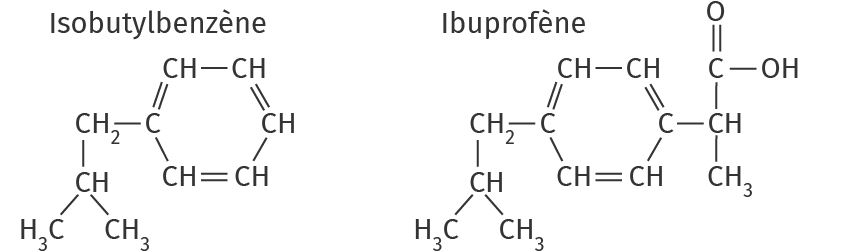
Il réalise le spectre IR de la molécule obtenue après synthèse.

Gabriel a-t-il réussi à synthétiser la molécule d'ibuprofène ? Justifier.


Il réalise le spectre IR de la molécule obtenue après synthèse.

Gabriel a-t-il réussi à synthétiser la molécule d'ibuprofène ? Justifier.
Détails du barème
TOTAL /4 pts
1 pt
Repérer le groupe caractéristique de l'ibuprofène que l'isobutylbenzène ne possède pas.1 + 1 pts
Repérer les deux bandes du spectre propres à ce groupe caractéristique et justifier avec les valeurs des nombres d'onde en cm-1.0,5 + 0,5 pt
Conclure sur le spectre IR d'un acide carboxylique et la synthèse de l'ibuprofène.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21 Bac Un acide aminé : la glutamine
✔ RAI/MOD : Respecter les conventions en chimie organiqueL'acide aminé le plus abondant dans l'organisme, la glutamine et particulièrement la L-glutamine, joue un rôle fondamental pour la régulation acido-basique du sang. La glutamine est particulièrement utilisée par les sportifs de haut niveau pour améliorer les performances physiques.
D'après le sujet Bac S, Polynésie, 2018.
Doc. 1
Étapes de la réaction
La glutamine est synthétisée au sein de l'organisme à partir de l'acide glutamique qui fixe une molécule d'ammoniac \text{NH}_3.


Doc. 2
Les groupes caractéristiques

Doc. 3
Table des bandes d'absorption en IR
| Liaison | \sigma (cm-1) | Intensité |
| \text{O} - \text{H} alcool libre | 3 500-3 700 | Forte, fine |
| \text{O} - \text{H} alcool lié | 3 200-3 400 | Forte, large |
| \text{O} - \text{H} acide carboxylique | 2 500-3 200 | Forte à moyenne, large |
| \text{N} - \text{H} amine | 3 100-3 500 | Moyenne |
| \text{N} - \text{H} amide | 3 100-3 500 | Forte |
| \text{N} - \text{H} amine ou amide | 1 560-1 640 | Forte ou moyenne |
| \text{C} = \text{O} ester | 1 700-1 740 | Forte |
| \text{C} = \text{O} amide | 1 650-1 740 | Forte |
| \text{C} = \text{O} aldéhyde et cétone | 1 650-1 730 | Forte |
| \text{C} = \text{O} acide | 1 680-1 710 | Forte |
Doc. 4
Spectre IR de la glutamine

1. Doc. 1 et 2
Reproduire les formules semi-développées de l'acide glutamique et de la glutamine, entourer les groupes caractéristiques et donner leurs noms.
Cliquez pour accéder à une zone de dessin
2.
Dans le cas de molécules polyfonctionnelles, la nomenclature officielle impose le choix d'un groupe caractéristique prioritaire qui donne son nom à la molécule. Le nom de la glutamine en nomenclature officielle est : acide 2-amino-5-amidopentanoïque. Quel est le groupe caractéristique prioritaire pour la glutamine ?
3. Doc. 3 et 4 Pour identifier la glutamine, on utilise la technique de spectroscopie IR. Donner trois arguments justifiant que le spectre IR proposé peut être celui de la glutamine.
3. Doc. 3 et 4 Pour identifier la glutamine, on utilise la technique de spectroscopie IR. Donner trois arguments justifiant que le spectre IR proposé peut être celui de la glutamine.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22
Copie d'élève à commenter
Proposer une justification pour chaque erreur relevée par le correcteur.
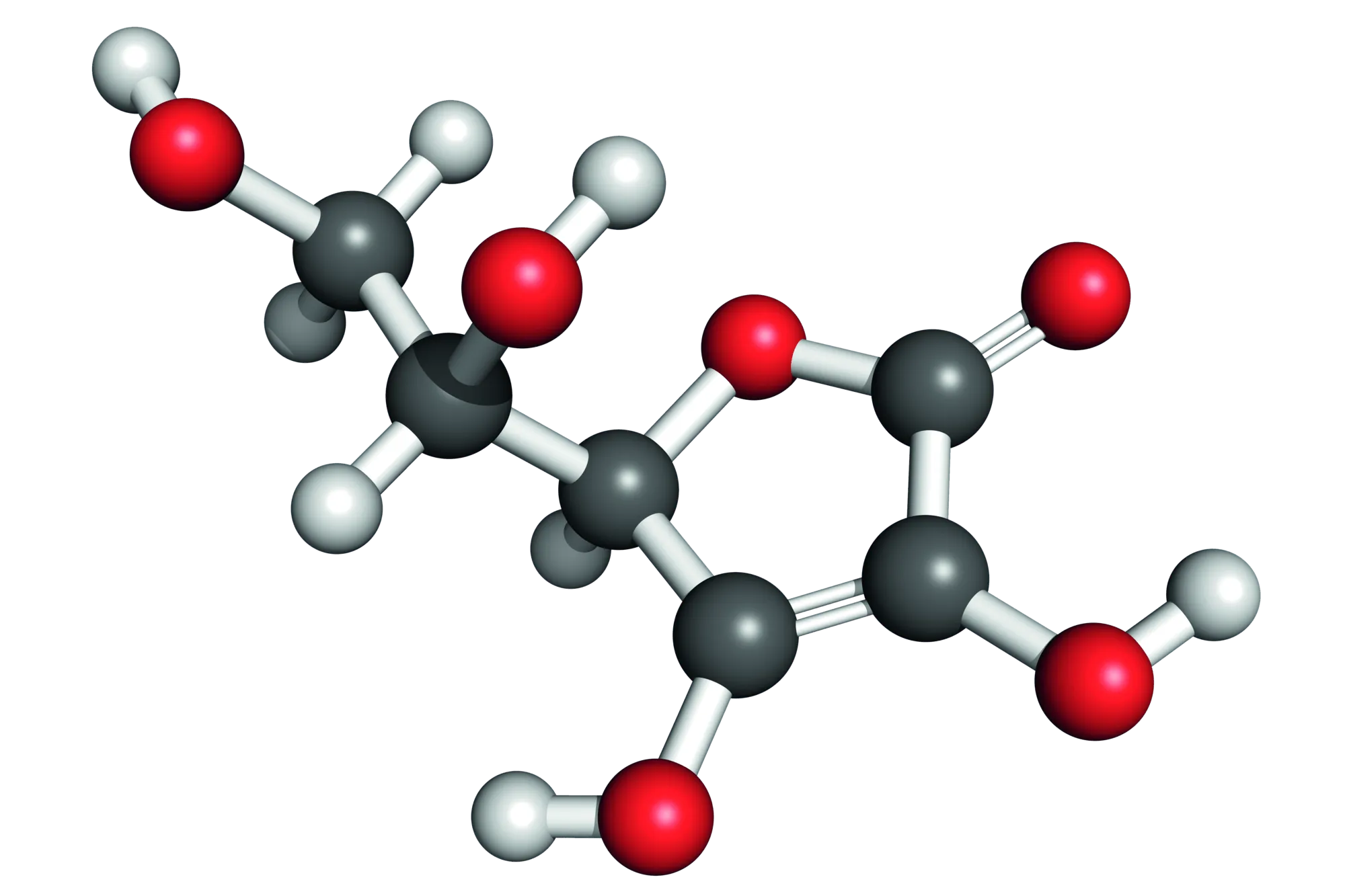
Cette molécule est l'acide ascorbique (vitamine C).
1.
La molécule de vitamine C possède 4 groupes carboxyles.
Sa formulesemi-développée est : \text{C}_6\text{H}_8\text{O}_6.
2. Le spectre IR de la molécule d'acide ascorbique a des bandes caractéristiques correspondantau liaison \sout{-\text{C}=\text{O}} d'un alcool vers 3 200 cm.
3. La formulebrutede l'acide ascorbique est :

4. Le nom de la molécule a est leméthylpentan-2-al.
5. Le nom de la molécule b est le2,méthylpropanoïque.
 Molécule a
Molécule a
 Molécule b
Molécule b
Sa formule
2. Le spectre IR de la molécule d'acide ascorbique a des bandes caractéristiques correspondant
3. La formule

4. Le nom de la molécule a est le
5. Le nom de la molécule b est le


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23Les dangers de la cigarette
✔ APP : Savoir extraire l'information utile sur des supports variésLe document ci-dessous représente les principales molécules présentes dans une cigarette. Nous allons étudier cinq d'entre elles plus précisément.

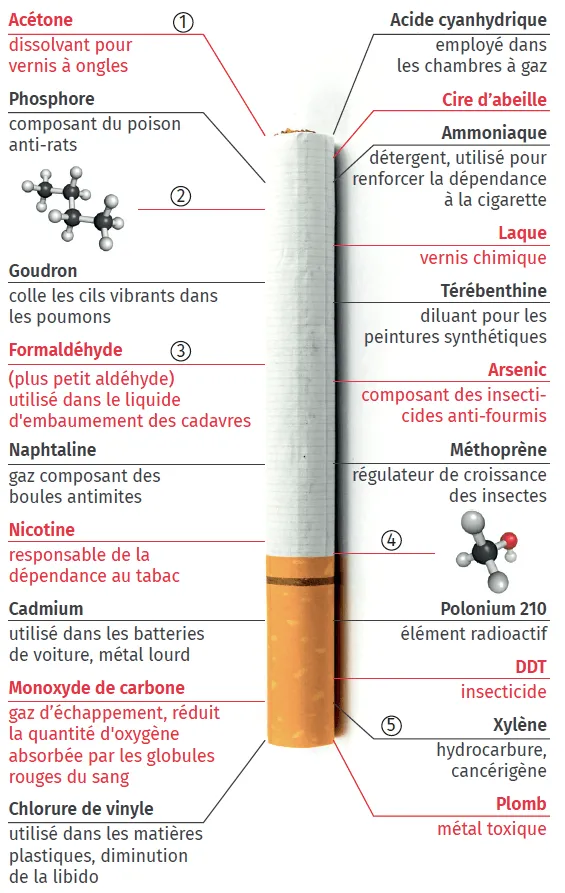
1.
Identifier, parmi les molécules suivantes, celles qui correspondent aux composés 1, 3 et 5 de l'affiche.
a.
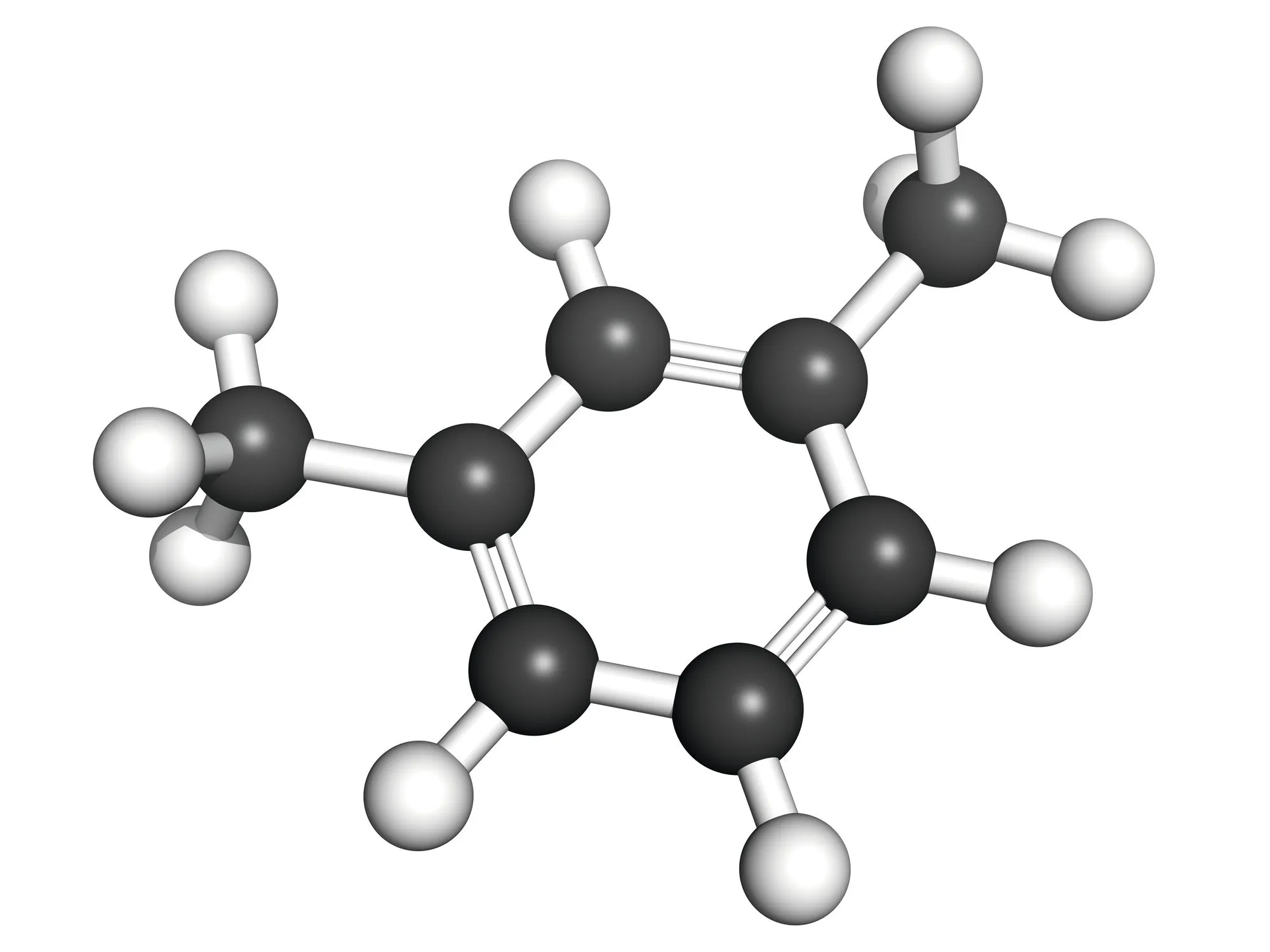
b.
c.
a.


b.

c.

2.
À partir des formules données ci-dessus et du document, donner la formule brute, la formule semi-développée et le nom des 5 molécules repérées sur l'image.
Cliquez pour accéder à une zone de dessin
3.
Entourer les groupes caractéristiques présents dans chaque molécule.

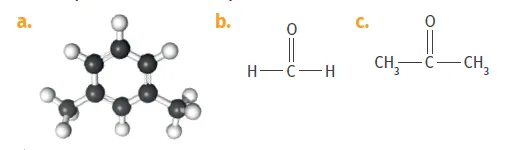
4. Quel autre nom peut-on donner au formaldéhyde ? à l'acétone ?
5. Comment pourrait-on différencier en spectroscopie IR la molécule de formaldéhyde et le xylène ?


4. Quel autre nom peut-on donner au formaldéhyde ? à l'acétone ?
5. Comment pourrait-on différencier en spectroscopie IR la molécule de formaldéhyde et le xylène ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24
Liquide ou gaz ?
✔ APP : Savoir extraire l'information utile sur des supports
variésUne entreprise pharmaceutique fabrique du paracétamol. C'est un médicament proche de l'aspirine par ses propriétés analgésiques et antipyrétiques. On le retrouve dans de nombreux médicaments. L'entreprise réalise le spectre IR du paracétamol obtenu après synthèse en phase gaz, présenté ci-dessous.

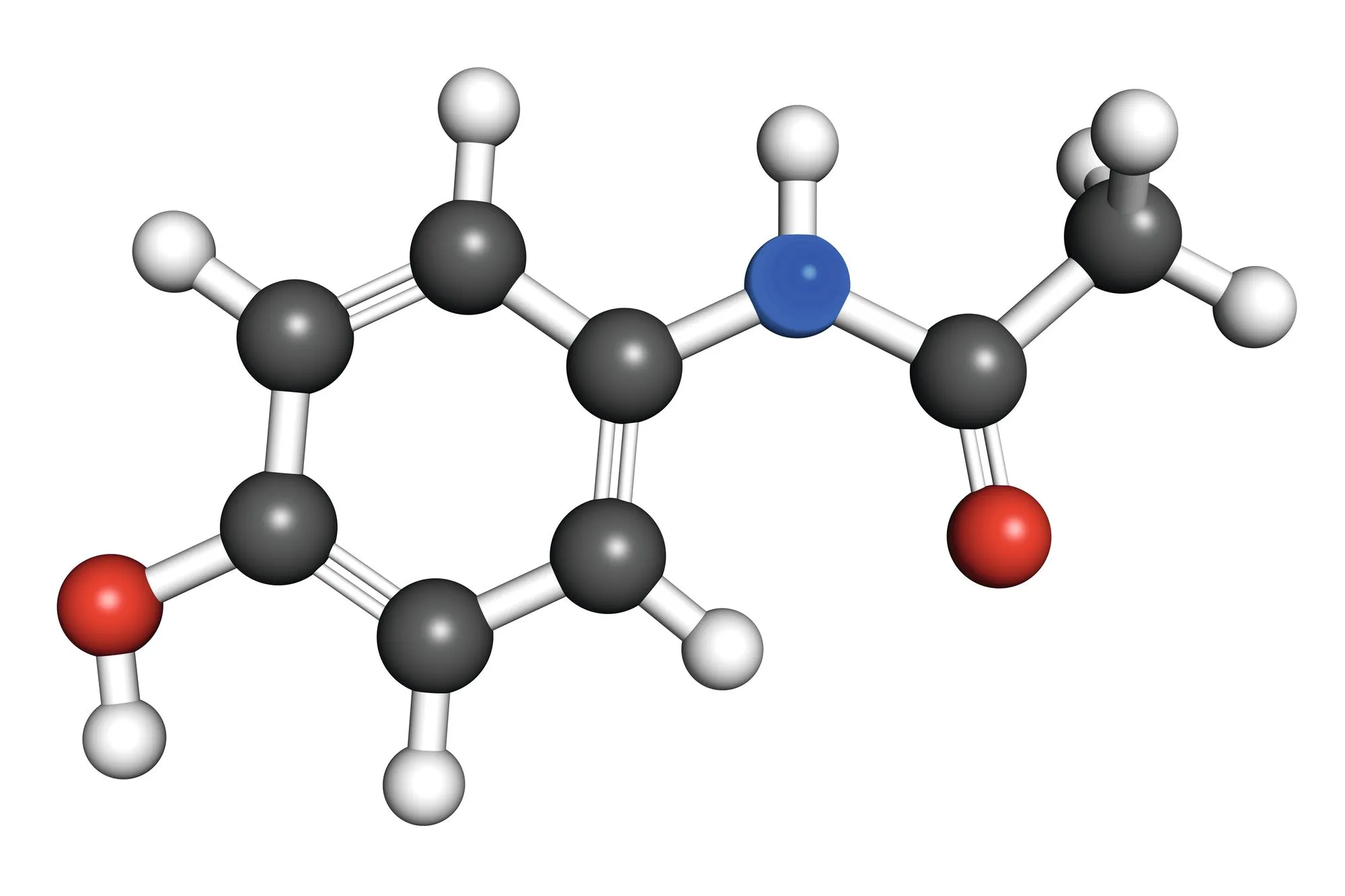
La molécule de paracétamol est représentée ci-dessous.

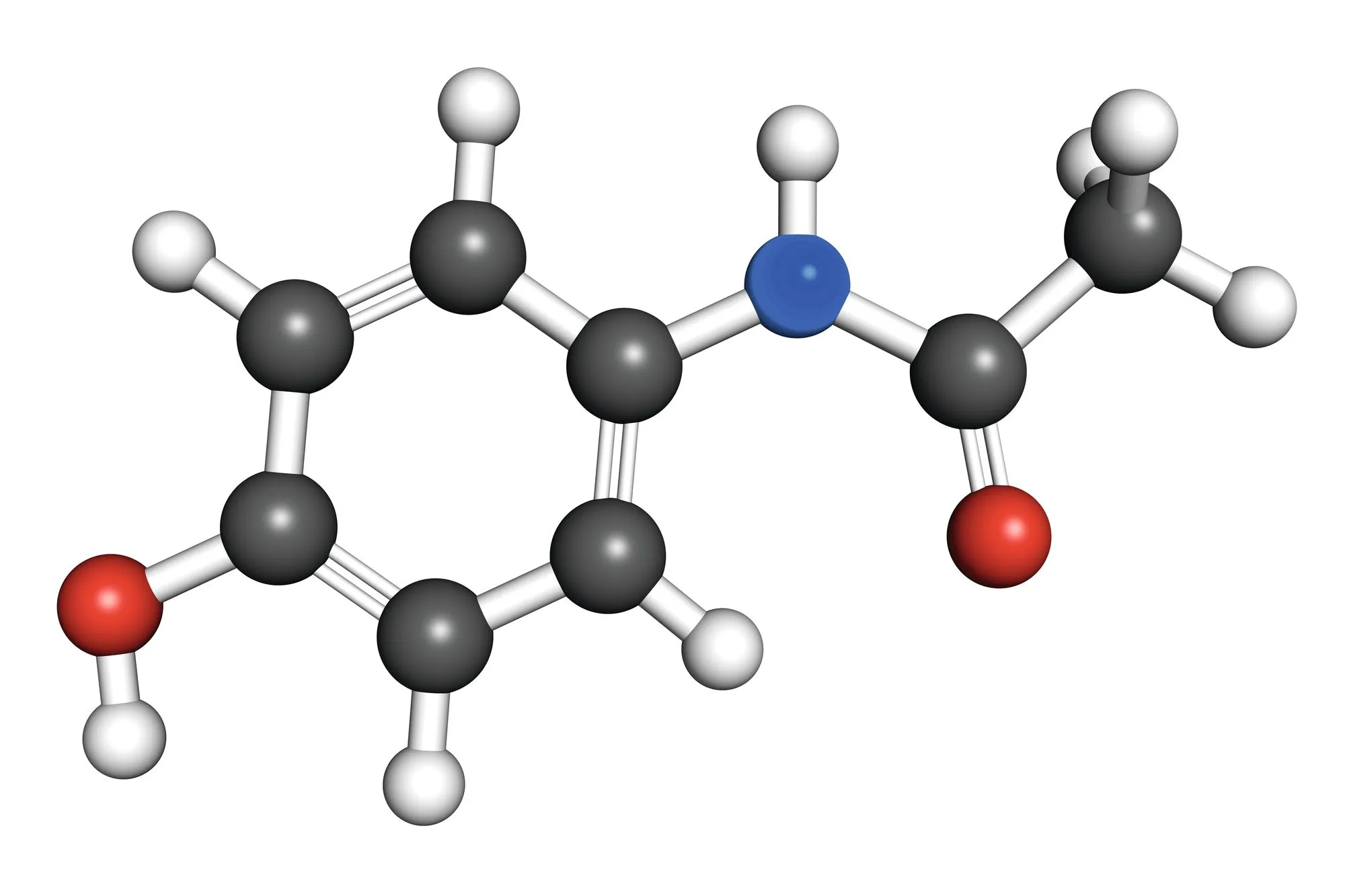
1.
Donner ses formules brute et semi-développée.
Cliquez pour accéder à une zone de dessin
2.
Entourer les groupes caractéristiques présents dans la molécule de paracétamol ci-dessous (on pourra s'aider des groupes caractéristiques présentés dans le doc. 1 ci-dessous).

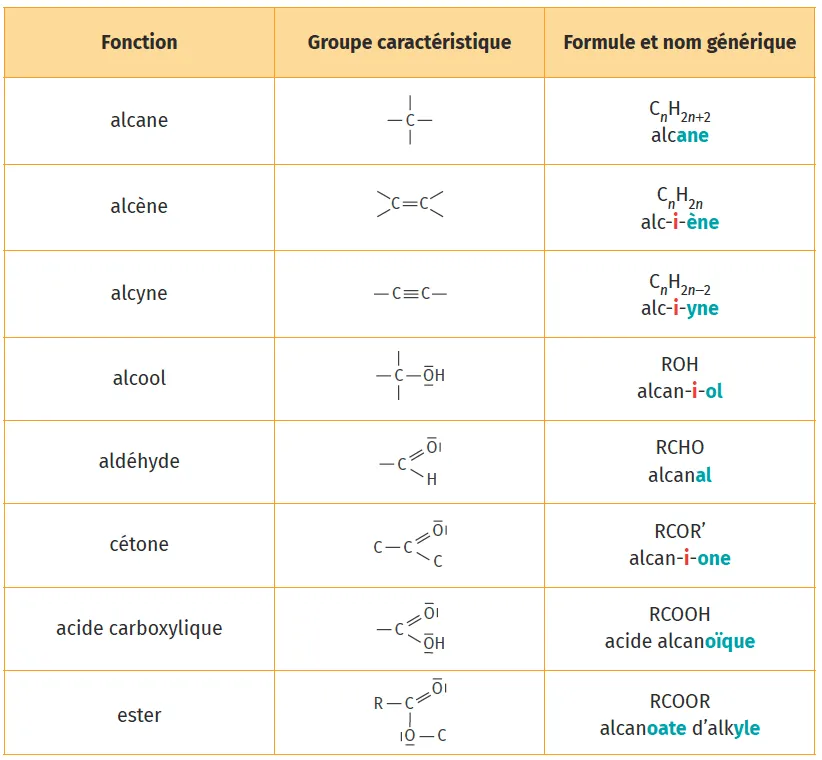

Doc. 1
Les groupes caractéristiques




3.
Le paracétamol est aussi appelé acétyl-para-amino-phénol, expliquer d'où vient son nom usuel.
4. Attribuer les pics a, b, c, d et e du spectre IR ci-dessus
5. Comment serait modifié le spectre IR du paracétamol en phase liquide (condensée) ? Justifier.
4. Attribuer les pics a, b, c, d et e du spectre IR ci-dessus
5. Comment serait modifié le spectre IR du paracétamol en phase liquide (condensée) ? Justifier.
Conseil
Un groupement phényl est un groupement de 6 atomes de carbone qui s'associent en cycle. Si onajoute un groupement hydroxyle (- \text{OH}) sur ce cycle (comme pour le paracétamol), on parle alors de phénol (terminaison -ol de l'alcool).
De plus, le préfixe para- signifie qu'il y a deux groupements rattachés l'un en face de l'autre sur le groupement phényle, d'où le nom de paracétamol (le groupe amide est en position para- par rapport au groupe hydroxyle sur le phényle).
De plus, le préfixe para- signifie qu'il y a deux groupements rattachés l'un en face de l'autre sur le groupement phényle, d'où le nom de paracétamol (le groupe amide est en position para- par rapport au groupe hydroxyle sur le phényle).
Groupement phényl :





Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

