Chapitre 2
Cours
Composition des solutions aqueuses
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Notion de concentration
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
ASolution aqueuse
Une solution est un mélange.
Le solvant est le composant majoritaire du mélange.
Le soluté est l'espèce qui est dispersée dans le solvant.
Le solvant est le composant majoritaire du mélange.
Le soluté est l'espèce qui est dispersée dans le solvant.
Solvant + Soluté(s) = Solution
Remarque
On parle de solution aqueuse lorsque le solvant est l'eau.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1 Limonade maison


La limonade est une solution aqueuse. Les principaux solutés sont le sucre, le \text{CO}_{2} et l'acide citrique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BConcentration en soluté
La concentration en masse (en g·L-1) d'un soluté est la masse m (en g) de soluté dissous dans le volume V (en L) de la solution.
Exemple : si on dissout 1 g de sel dans 1/2 L de soupe, la concentration en sel de la soupe sera de :\gamma_{\mathrm{sel} }=\dfrac{1}{0\text{,}5}=2 g/L.
La concentration d'un soluté en solution est à distinguer de la masse volumique de la solution. Les deux grandeurs s'expriment parfois dans la même unité mais ne représentent pas la même chose. La masse volumique d'une substance concerne la masse d'un ensemble. La concentration concerne la masse d'un soluté dans un ensemble.
Exemple : concentration en sucre d'un sirop : \gamma_{\text {sucre}}=20 g/L.
Masse volumique du sirop : \rho_{\text {sirop}}=1 \, 180 g/L.
\gamma=\dfrac{m}{V}
Exemple : si on dissout 1 g de sel dans 1/2 L de soupe, la concentration en sel de la soupe sera de :\gamma_{\mathrm{sel} }=\dfrac{1}{0\text{,}5}=2 g/L.
La concentration d'un soluté en solution est à distinguer de la masse volumique de la solution. Les deux grandeurs s'expriment parfois dans la même unité mais ne représentent pas la même chose. La masse volumique d'une substance concerne la masse d'un ensemble. La concentration concerne la masse d'un soluté dans un ensemble.
Exemple : concentration en sucre d'un sirop : \gamma_{\text {sucre}}=20 g/L.
Masse volumique du sirop : \rho_{\text {sirop}}=1 \, 180 g/L.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
La formule de la concentration peut aussi s'écrire sous la forme : {V=\dfrac{m}{\gamma}} ou {m=\gamma \cdot V.}
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Concentration en masse (en g/L) : masse de soluté contenue dans un volume de référence de solution.
- Masse volumique : masse d'une substance (solide, liquide ou gaz) contenue dans un volume de cette substance.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
C Concentration maximum
On ne peut dissoudre qu'une quantité limitée de soluté dans un
volume de solvant. Lorsque l'on ne peut plus dissoudre de soluté, on dit que la solution est saturée en soluté.
La solubilité est la concentration à partir de laquelle un soluté ne peut plus se dissoudre davantage. La solubilité est donc la concentration maximum d'un soluté dans un solvant donné.
La solubilité est la concentration à partir de laquelle un soluté ne peut plus se dissoudre davantage. La solubilité est donc la concentration maximum d'un soluté dans un solvant donné.
Remarque
- La solubilité dépend du soluté, du solvant et de la température.
- Une solution peut être saturée avec un soluté mais pas forcément avec un autre
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Le soluté semble disparaître dans le solvant. Or, il est toujours là ! Ses éléments constituants sont juste trop petits pour être distingués une fois séparés par le solvant.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2 Dans un marais salant


Le sel est récolté lorsque l'eau de mer sature en sel dans les marais salants.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Application
La solubilité du chlorure de sodium (sel) est de s = 358 g\cdotL-1. Quelle masse m de sel peut-on espérer récolter dans un marais salant à partir de 1,2 m3 d'une solution saturée ?
1\text{,}2 m3 =1\text{,}2 \times 10^{3} L
m=s \cdot V=358 \times 1\text{,}2 \times 10^{3} g
m=4\text{,}3 \times 10^{5} g =4\text{,}3 \times 10^{2} kg.
La masse du sel qu'on pourra espérer récolter est de 4\text{,}3 \times 10^{2} kg.
Corrigé
1\text{,}2 m3 =1\text{,}2 \times 10^{3} L
m=s \cdot V=358 \times 1\text{,}2 \times 10^{3} g
m=4\text{,}3 \times 10^{5} g =4\text{,}3 \times 10^{2} kg.
La masse du sel qu'on pourra espérer récolter est de 4\text{,}3 \times 10^{2} kg.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Préparation de solutions
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
A Dissolution
La dissolution est la dispersion d'un soluté dans un solvant.
On dissout souvent des solides dans des liquides. On peut aussi dissoudre des gaz.
Exemples : dissolution du sucre dans du thé ou dissolution de dioxyde de carbone pour fabriquer de l'eau gazeuse avec une machine (doc. 3).
Agiter permet d'accélérer la dissolution ainsi que d'homogénéiser la solution finale.
Chauffer permet souvent d'accélérer la dissolution et d'augmenter la solubilité en général. Attention toutefois à ne pas évaporer le solvant !
Exemple : pour faire un chocolat chaud, on chauffe le lait avant d'ajouter du chocolat en poudre. Dans le lait froid, de la poudre reste en surface.
On dissout souvent des solides dans des liquides. On peut aussi dissoudre des gaz.
Exemples : dissolution du sucre dans du thé ou dissolution de dioxyde de carbone pour fabriquer de l'eau gazeuse avec une machine (doc. 3).
Agiter permet d'accélérer la dissolution ainsi que d'homogénéiser la solution finale.
Chauffer permet souvent d'accélérer la dissolution et d'augmenter la solubilité en général. Attention toutefois à ne pas évaporer le solvant !
Exemple : pour faire un chocolat chaud, on chauffe le lait avant d'ajouter du chocolat en poudre. Dans le lait froid, de la poudre reste en surface.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3 Dissolution et effervescent


Le dégagement gazeux de \text{CO}_{2} agite la solution.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Diluer : ajouter du solvant sans ajouter de soluté.
- Dissoudre : disperser un soluté dans un solvant.
- Solution fille : solution obtenue après dilution.
- Solution mère : solution initiale qui va être diluée.
- Trait de jauge : marque ou trait qui indique le volume.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
B Dilution
Une dilution est la diminution de la concentration d'une solution par ajout de solvant sans ajout de soluté.
La solution mère est la solution de départ et la solution fille est la solution obtenue après dilution. La solution fille est donc moins concentrée que la solution mère.
Exemple : quand on ajoute de l'eau dans un café pour qu'il soit moins fort, la solution mère est le café fort et la solution fille est le café doux final.
La solution mère est la solution de départ et la solution fille est la solution obtenue après dilution. La solution fille est donc moins concentrée que la solution mère.
Exemple : quand on ajoute de l'eau dans un café pour qu'il soit moins fort, la solution mère est le café fort et la solution fille est le café doux final.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Retrouvez en vidéo la méthode de dilution en pratique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CConservation de la masse
Quelle que soit la technique, la masse de soluté prélevée se retrouve toujours dans la solution préparée.
Soit : \dfrac{\gamma_{\text {mère }}}{\gamma_\text{fille }}=\dfrac{V_{\text {fille }}}{V_{\text {mère}}}=F= facteur de dilution.
- Cas de la dissolution : La masse de soluté pesée est égale à celle qui se retrouve en solution : m_{\text {soluté pesé}}=m_{\text {soluté en solution }}=\gamma_{\text {solution}} \cdot V_{\text {solution}}.
- Cas de la dilution : La masse de soluté prélevée dans la solution mère est égale à la masse de soluté contenue dans la solution fille : m_{\text {mère }}=m_{\text {fille }}.
On a donc : \gamma_{\text {mère }} \cdot V_{\text {mère}}=\gamma_{\text {fille}} \cdot V_{\text {fille}}.
Soit : \dfrac{\gamma_{\text {mère }}}{\gamma_\text{fille }}=\dfrac{V_{\text {fille }}}{V_{\text {mère}}}=F= facteur de dilution.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Application
Pour diluer par 5 une solution mère (F= 5 ) dans une fiole de 100,0 mL, V_{\text {mère}}=\dfrac{V_{\text {fille }}}{5}=\dfrac{100}{5}=20 mL. Il faut donc prélever 20 mL de
solution mère à la pipette jaugée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Attention à la lecture du volume avec une fiole jaugée : l'œil doit être bien placé à l'horizontale à la hauteur du bas du ménisque.
- Prélever la solution qui est au-dessus du trait de jauge, même sans avoir agité, revient à enlever du soluté en plus du solvant. La concentration ne sera plus celle souhaitée.
- Attention aux traits de jauge des pipettes : certaines en ont deux (volume mesuré entre les deux traits) et d'autres n'en n'ont qu'un (vider la pipette pour avoir le volume souhaité) !
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3Détermination de concentrations
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
A Échelle de teintes
Lorsqu'une espèce colorée est diluée, sa couleur devient plus
claire (doc. 4). En préparant une série de solutions de concentrations connues d'une même espèce colorée (appelée échelle de teintes), on peut ensuite comparer avec la couleur d'une solution de concentration inconnue et obtenir un encadrement de sa valeur.
Exemple : avec des solutions de permanganate de potassium :

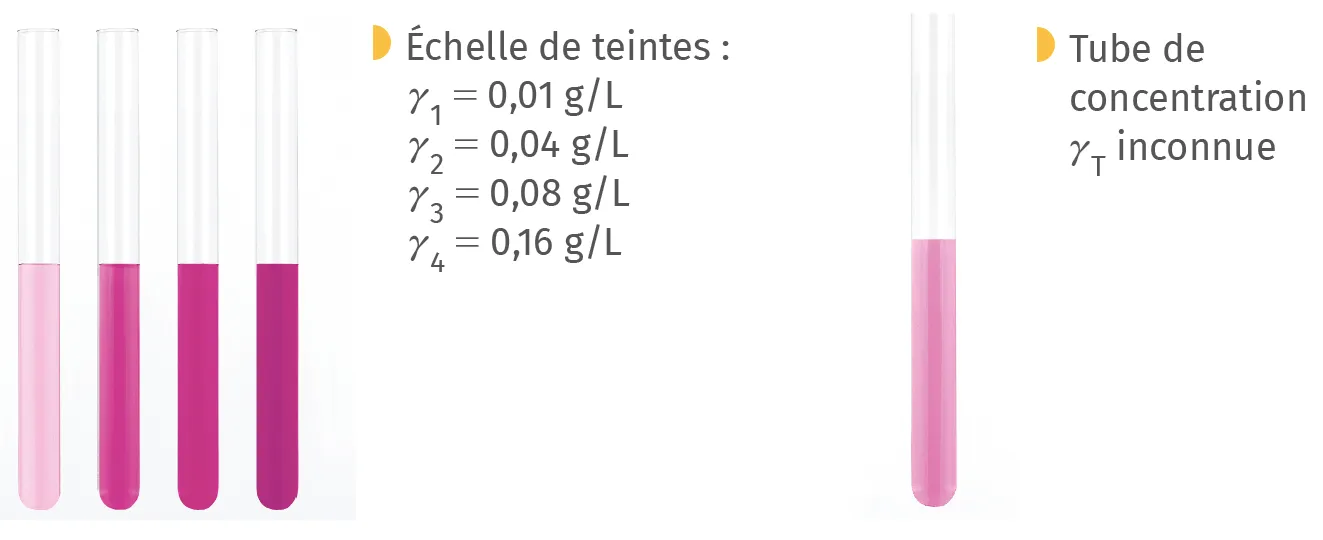
On obtient 0,01 g/L \leq \gamma_{\mathrm {T}} \leq 0,04 g/L.
Exemple : avec des solutions de permanganate de potassium :


On obtient 0,01 g/L \leq \gamma_{\mathrm {T}} \leq 0,04 g/L.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 4 Dessin à l'aquarelle


On dilue les aquarelles pour obtenir des nuances de couleurs.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
B Courbe d'étalonnage
Lorsque l'on peut mesurer une grandeur physique (notée G) en lien avec la concentration (notée \gamma), on peut montrer graphiquement ce lien.
En préparant une série de solutions de concentrations \gamma connues d'une même espèce et en mesurant la valeur de G pour chacune d'entre elles, on peut tracer une courbe G=f(\gamma).
Pour plus de précision :
Exemple (d'après un sujet bac) :
détermination de la concentration \gamma en glucose par mesure de la masse volumique \rho d'une solution :

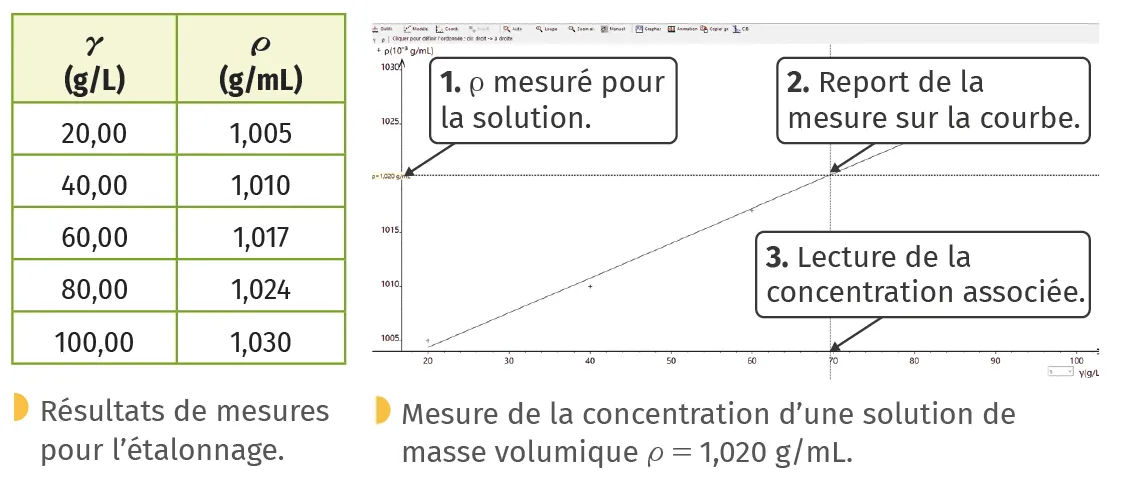
Graphiquement, on déduit \gamma=70 g/L.
En préparant une série de solutions de concentrations \gamma connues d'une même espèce et en mesurant la valeur de G pour chacune d'entre elles, on peut tracer une courbe G=f(\gamma).
Pour plus de précision :
- effectuer une large gamme de mesures pour réaliser la courbe afin de gagner en précision ;
- modéliser (déterminer une relation mathématique entre les grandeurs représentées)/lisser la courbe d'étalonnage.
Exemple (d'après un sujet bac) :
détermination de la concentration \gamma en glucose par mesure de la masse volumique \rho d'une solution :


Graphiquement, on déduit \gamma=70 g/L.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Comparer les teintes avec la même verrerie car la couleur s'assombrit avec l'épaisseur.
- Pour distinguer les couleurs, mettre un fond uniforme blanc derrière les solutions.
- Resserrer les concentrations de l'échelle de teintes pour gagner en précision.

- La concentration inconnue doit être dans la gamme d'étalonnage.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Courbe d'étalonnage : courbe reliant la concentration à une grandeur physique mesurable.
- Échelle de teintes : série de couleurs dégradées.
- Solution étalon : solution avec une concentration connue.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Revoir en vidéo l'utilisation de la courbe d'étalonnage ().
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille



