Chapitre
Le coin des experts
Le coin des experts
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9La carboglace
✔ Déterminer les paramètres géométriques d'une maille
.
La carboglace, de formule chimique CO2, correspond à la forme solide du dioxyde de carbone. Elle cristallise sous la forme d'un réseau cubique à faces centrées.



1. Proposez une stratégie pour déterminer le paramètre \alpha de la maille puis la distance entre deux atomes de carbone de deux molécules voisines.
2. Comparez cette valeur à la taille l de la liaison C=O dans la molécule de CO2 : l = 120 pm.
.
La carboglace, de formule chimique CO2, correspond à la forme solide du dioxyde de carbone. Elle cristallise sous la forme d'un réseau cubique à faces centrées.
Données
- Masse d'une molécule de CO2 : m = 7\text{,}31 \times 10^{-23} g
- La densité de la carboglace vaut d = 1\text{,}56
Doc.
Carboglace et structure cristalline.



1. Proposez une stratégie pour déterminer le paramètre \alpha de la maille puis la distance entre deux atomes de carbone de deux molécules voisines.
2. Comparez cette valeur à la taille l de la liaison C=O dans la molécule de CO2 : l = 120 pm.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
10Fer \alpha et acier
✔ Dénombrer les atomes par maille
Jusqu'à 910 °C, le fer cristallise dans une structure cubique centrée, connue sous le nom de variété \alpha. Le rayon du fer vaut r_1 = 124 pm. Dans le fer \alpha, des atomes de carbone peuvent s'insérer aux centres des faces de la maille ou aux milieux des arêtes. On qualifie ces sites d'octaédriques. La ferrite est un acier correspondant à une solution solide de formule FeCz, obtenue par occupation partielle de ces positions.


 En rouge, un site octaédrique.
En rouge, un site octaédrique.
1. Déterminez z dans la formule du composé FeCz si tous les sites octaédriques sont occupés par des atomes de carbone.
2. Sachant que le paramètre de maille vaut a = \dfrac{4 r_1}{\sqrt{3}}, exprimez le rayon théorique r' de l'atome de carbone inséré dans ces aciers en fonction du paramètre de maille a et en supposant qu'il y a tangence des atomes de Fe et de C sur l'arête du cube.
3. Calculez la valeur du rayon théorique sachant que le rayon de l'atome de carbone vaut r_2 = 77 pm. Discutez du résultat.
Jusqu'à 910 °C, le fer cristallise dans une structure cubique centrée, connue sous le nom de variété \alpha. Le rayon du fer vaut r_1 = 124 pm. Dans le fer \alpha, des atomes de carbone peuvent s'insérer aux centres des faces de la maille ou aux milieux des arêtes. On qualifie ces sites d'octaédriques. La ferrite est un acier correspondant à une solution solide de formule FeCz, obtenue par occupation partielle de ces positions.
Doc. 1
Ferrite observée au microscope


Doc. 2
Sites octaédriques d'un réseau cubique centré.

2. Sachant que le paramètre de maille vaut a = \dfrac{4 r_1}{\sqrt{3}}, exprimez le rayon théorique r' de l'atome de carbone inséré dans ces aciers en fonction du paramètre de maille a et en supposant qu'il y a tangence des atomes de Fe et de C sur l'arête du cube.
3. Calculez la valeur du rayon théorique sachant que le rayon de l'atome de carbone vaut r_2 = 77 pm. Discutez du résultat.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11La synthèse artificielle des pierres précieuses : une aventure à haute température
✔ Distinguer maille, cristal, minéral et roche
Les connaissances sur la physique et la chimie des roches ont permis progressivement d'envisager de reproduire les conditions dans lesquelles se forment naturellement les minerais d'intérêt tels que le saphir, le rubis ou encore le diamant, et ainsi de les synthétiser artificiellement au laboratoire ou dans l'industrie.

 Une étude géologique à Madagascar a mis en évidence certaines conditions de formation métamorphique du rubis à la limite des domaines de l'éclogite et de la granulite. Les saphirs, quant à eux, proviennent d'une chambre magmatique située à la limite croûte continentale / manteau supérieur (entre 650 et 750 °C, à 5 kbar).
Une étude géologique à Madagascar a mis en évidence certaines conditions de formation métamorphique du rubis à la limite des domaines de l'éclogite et de la granulite. Les saphirs, quant à eux, proviennent d'une chambre magmatique située à la limite croûte continentale / manteau supérieur (entre 650 et 750 °C, à 5 kbar).

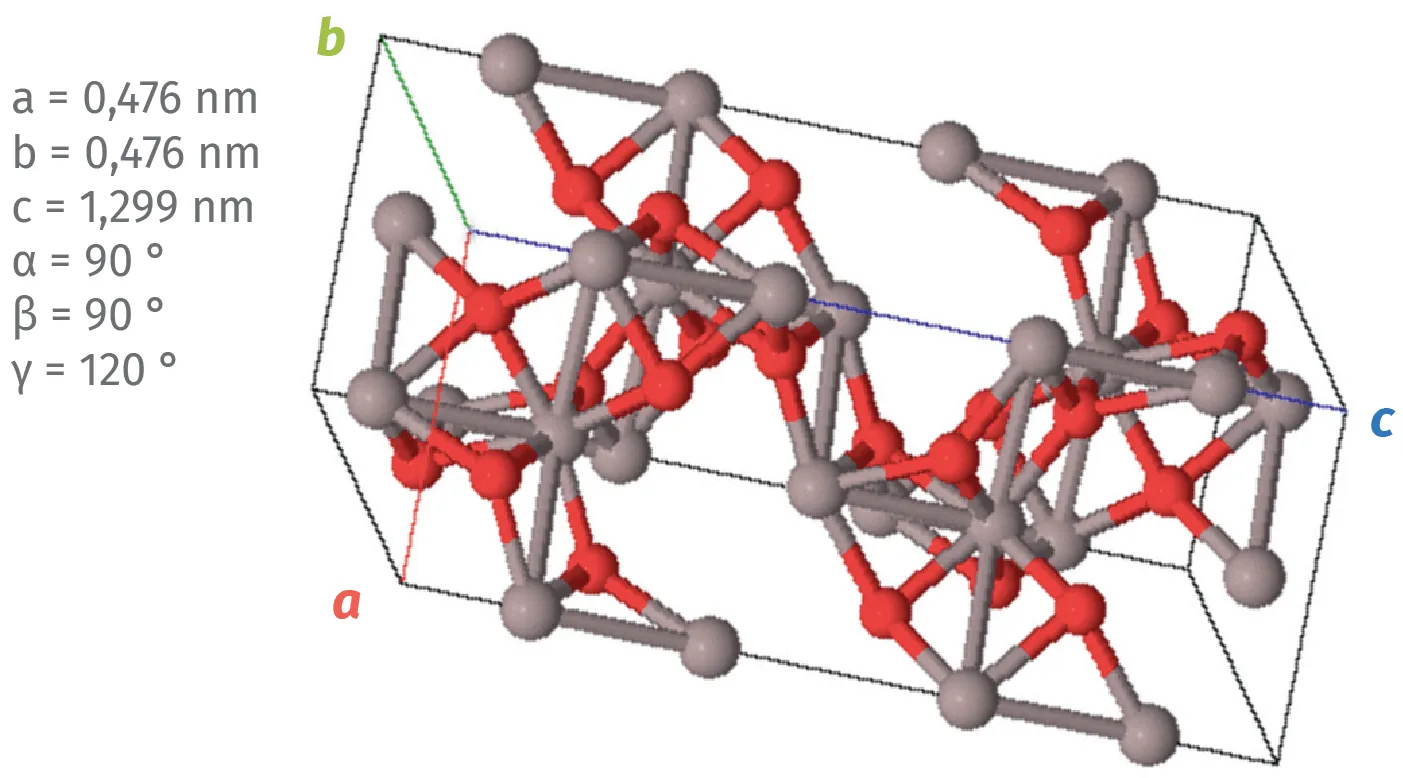 Ils ont le même système cristallin. Chimiquement, il s'agit d'une alumine anhydre (ou oxyde d'aluminium cristallisé) de formule chimique Al2O3. La couleur des saphirs et rubis est liée à la présence d'éléments comme le chrome (Cr), le fer (Fe), le titane (Ti), le manganèse (Mn), etc.
Ils ont le même système cristallin. Chimiquement, il s'agit d'une alumine anhydre (ou oxyde d'aluminium cristallisé) de formule chimique Al2O3. La couleur des saphirs et rubis est liée à la présence d'éléments comme le chrome (Cr), le fer (Fe), le titane (Ti), le manganèse (Mn), etc.

À l'aide des documents et de vos connaissances, montrez qu'un composé peut cristalliser de différentes façons et expliquez en quoi nos connaissances permettent aujourd'hui leur synthèse artificielle.
Les connaissances sur la physique et la chimie des roches ont permis progressivement d'envisager de reproduire les conditions dans lesquelles se forment naturellement les minerais d'intérêt tels que le saphir, le rubis ou encore le diamant, et ainsi de les synthétiser artificiellement au laboratoire ou dans l'industrie.
Doc. 1
Saphir (a) et rubis (b) observés à l'œil nu.


Doc. 2
Réseau cristallin du rubis et du saphir.


Doc. 3
Diagramme de pression (P) et température (T) et des principaux domaines du métamorphisme.

Doc. 4
Procédé de Verneuil (1902) : fabrication de gemmes synthétiques.
La synthèse est obtenue par la fonte de l'alumine au moyen d'un chalumeau à plus de 2 500 °C. Le cristal se forme goutte à goutte, par superposition de très fines couches de matière fondue. Au final, il ressemble à un stalagmite et porte le nom de boule, de carotte ou de bouteille.
Le dopage ou l'adjonction d'oxydes métalliques lors de la fabrication permet de donner la couleur : le chrome pour le rouge, le cobalt ou le fer et le titane pour le bleu, le nickel pour le vert, le fer pour le jaune ou le bleu clair, le manganèse pour le rose-orangé […].
Le processus complet de fabrication, sous une température minutieusement contrôlée, dure de quelques heures à quelques jours.
Le dopage ou l'adjonction d'oxydes métalliques lors de la fabrication permet de donner la couleur : le chrome pour le rouge, le cobalt ou le fer et le titane pour le bleu, le nickel pour le vert, le fer pour le jaune ou le bleu clair, le manganèse pour le rose-orangé […].
Le processus complet de fabrication, sous une température minutieusement contrôlée, dure de quelques heures à quelques jours.
À l'aide des documents et de vos connaissances, montrez qu'un composé peut cristalliser de différentes façons et expliquez en quoi nos connaissances permettent aujourd'hui leur synthèse artificielle.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BLes silicates d'alumine, témoins d'une histoire
✔ Associer un assemblage minéralogique à des conditions de formation d'une roche.
✔ Reconstituer succinctement une histoire géologique locale.
.
Le massif de l'Arize se situe au nord du massif des Pyrénées. Cette chaîne de montagne s'est formée dans un contexte de convergence des plaques lithosphériques. Les roches, telles que celles du massif de l'Arize, ont alors subi de fortes élévations de pression et de température.

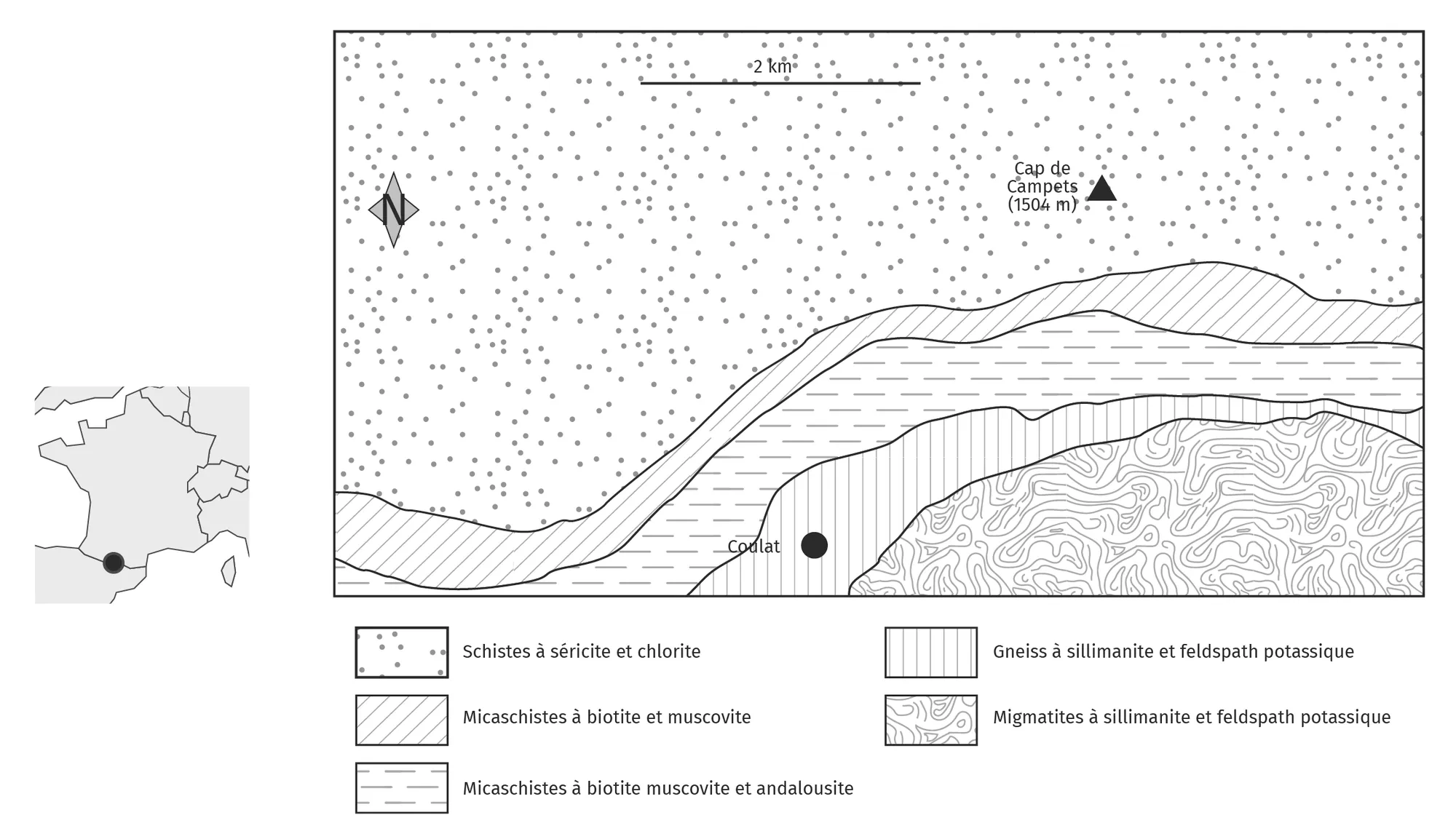

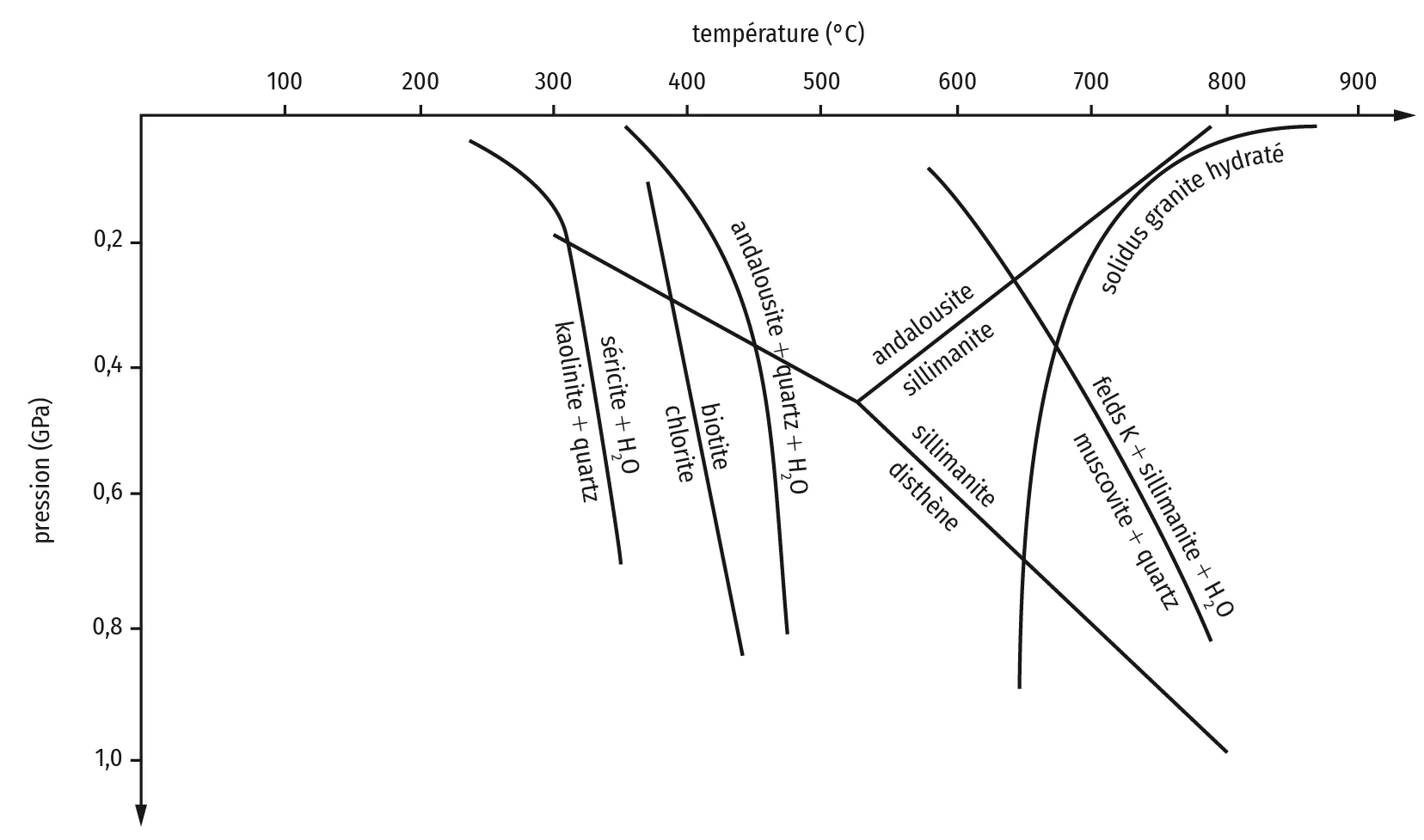
A l'aide des documents proposés et de vos connaissances, expliquez en quoi les minéraux présents dans les différentes roches témoignent de conditions de métamorphisme plus fortes au sud qu'au nord de la carte, et approchant la fusion.
✔ Reconstituer succinctement une histoire géologique locale.
.
Le massif de l'Arize se situe au nord du massif des Pyrénées. Cette chaîne de montagne s'est formée dans un contexte de convergence des plaques lithosphériques. Les roches, telles que celles du massif de l'Arize, ont alors subi de fortes élévations de pression et de température.
Doc.




A l'aide des documents proposés et de vos connaissances, expliquez en quoi les minéraux présents dans les différentes roches témoignent de conditions de métamorphisme plus fortes au sud qu'au nord de la carte, et approchant la fusion.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
C« Gaz nobles » à l'état solide !
✔
Dénombrer les atomes et faire le lien avec la masse volumique
.
Les éléments de la colonne 18 du tableau périodique sont des gaz monoatomiques inertes à température ambiante, d'où le nom de « gaz nobles ». Il faut les porter à des températures très basses pour obtenir des cristaux. On obtient alors des structures CFC.
1. Représentez la maille CFC et déduisez-en les rayons atomiques des 4 atomes de cette famille.
2. Calculez les masses volumiques pour chacun de ces éléments à l'état solide.
3. Après avoir rappelé la définition de la compacité c d'une structure cristalline, expliquer en quelques phrases pourquoi la compacité n'évolue pas de la même manière que la masse volumique pour les cristaux étudiés ici.
.
Les éléments de la colonne 18 du tableau périodique sont des gaz monoatomiques inertes à température ambiante, d'où le nom de « gaz nobles ». Il faut les porter à des températures très basses pour obtenir des cristaux. On obtient alors des structures CFC.
Doc.
Températures de fusion des éléments de la colonne 18.
| Élément | Néon | Argon | Krypton | Xénon |
| Masse molaire (g·mol-1) | 20,2 | 39,9 | 83,8 | 131,3 |
| a (nm) | 0,452 | 0,543 | 0,559 | 0,618 |
| T_{\text{fusion}} (K) | 24,5 | 83,9 | 116 | 161 |
1. Représentez la maille CFC et déduisez-en les rayons atomiques des 4 atomes de cette famille.
Cliquez pour accéder à une zone de dessin
2. Calculez les masses volumiques pour chacun de ces éléments à l'état solide.
3. Après avoir rappelé la définition de la compacité c d'une structure cristalline, expliquer en quelques phrases pourquoi la compacité n'évolue pas de la même manière que la masse volumique pour les cristaux étudiés ici.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

