Chapitre 8
Activité 1 - Activité d'exploration
Électrolyse de l'eau
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Objectif : Citer des exemples de dispositifs de conversion ou de stockage d'énergie chimique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Problématique de l'activité
Le dihydrogène \text{H}_2(\text{g}) et le dioxygène \text{O}_2(\text{g}) sont des gaz utilisés dans les piles à
combustible, développées pour produire des voitures moins polluantes.
Comment produire du dihydrogène à partir d'eau ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Production de dihydrogène
C'est à William Nicholson, chimiste britannique du XVIIIe siècle, qu'est attribuée la paternité de l'électrolyse de l'eau […]. Après avoir lu les travaux de Volta sur les batteries électriques, il en construisit une lui‑même et découvrit qu'en immergeant les extrémités des conducteurs électriques dans l'eau, cette dernière était décomposée en deux gaz, \text{H}_2(\text{g}) et \text{O}_2(\text{g}). Avec cette découverte, Nicholson devint le premier […] à effectuer une réaction chimique à l'aide de l'électricité.
L'eau ne se décompose pas spontanément en \text{H}_2(\text{g}) et en \text{O}_2(\text{g}). Il faut lui fournir de l'énergie, ainsi l'électrolyse est une réaction électrochimique « forcée », qui se fait dans un appareil appelé électrolyseur connecté à un générateur électrique.
Une cellule d'électrolyse est constituée par l'immersion de deux plaques métalliques appelées électrodes dans une solution électrolytique. Dans le cas de l'électrolyse, cette solution peut être une solution d'acide sulfurique (2\ \text{H}^+(\text{aq}) ; \text{SO}_4^{2-}(\text{aq})), car l'eau pure ne conduit pas le courant.
L'eau ne se décompose pas spontanément en \text{H}_2(\text{g}) et en \text{O}_2(\text{g}). Il faut lui fournir de l'énergie, ainsi l'électrolyse est une réaction électrochimique « forcée », qui se fait dans un appareil appelé électrolyseur connecté à un générateur électrique.
Une cellule d'électrolyse est constituée par l'immersion de deux plaques métalliques appelées électrodes dans une solution électrolytique. Dans le cas de l'électrolyse, cette solution peut être une solution d'acide sulfurique (2\ \text{H}^+(\text{aq}) ; \text{SO}_4^{2-}(\text{aq})), car l'eau pure ne conduit pas le courant.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Prototype de voiture à hydrogène


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3Schéma de l'électrolyse de l'eau

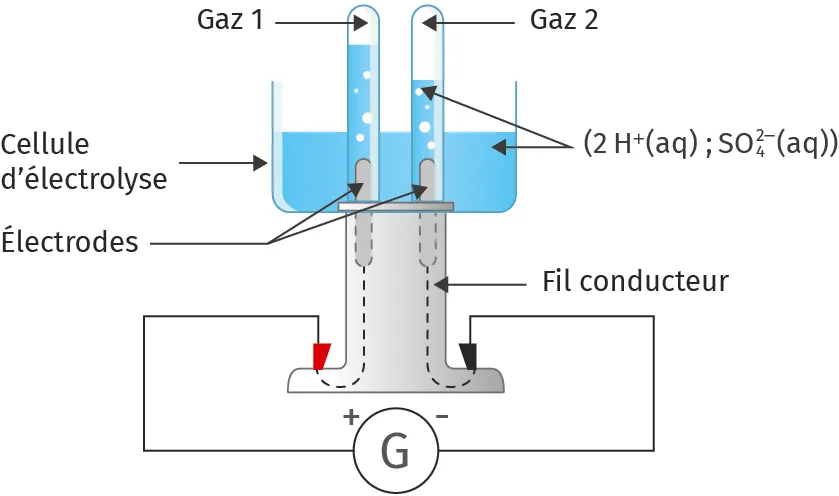
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Découvrez le fonctionnement d'un électrolyseur et d'une pile à combustible en cliquant .
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Couples d'oxydoréduction : \text{H}^+(\text{aq})/\text{H}_2(\text{g}) et \text{O}_2(\text{g})/\text{H}_2\text{O}
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Compétence(s)
APP : Extraire l'information utile
RAI/MOD : Modéliser une transformation
APP : Formuler des hypothèses
RAI/MOD : Modéliser une transformation
APP : Formuler des hypothèses
1. Déterminer les deux demi‑équations mises en jeu lors de l'électrolyse de l'eau (réactions aux électrodes) et en déduire l'équation globale de la réaction observée.
2. D'après le sens de branchement du générateur, déterminer et indiquer sur un schéma :
-
a. le sens de déplacement des électrons dans les fils et les électrodes.
b. les réactions chimiques ayant lieu aux électrodes.
c. le nom du gaz contenu dans chaque tube renversé sur les électrodes.
Cliquez pour accéder à une zone de dessin
3. Préciser le type de réaction (oxydation ou réduction) ayant lieu aux électrodes.
4. Expliquer pourquoi le volume du gaz 2 est deux fois plus élevé que celui du gaz 1.
4. Expliquer pourquoi le volume du gaz 2 est deux fois plus élevé que celui du gaz 1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Synthèse de l'activité
Préciser le rôle du générateur dans le cadre d'une électrolyse.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

