Chapitre 9
Exercices
Pour s'entraîner
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22Aspirine et acide salicylique
✔ APP : Extraire l'information utileL'aspirine est un des antipyrétiques (médicaments contre la fièvre) les plus utilisés au monde. On la synthétise à partir de l'acide salicylique, lui-même pouvant soit provenir de l'écorce de saule, soit être synthétisé en laboratoire. L'acide salicylique a également des propriétés antipyrétiques, mais il est moins efficace que l'aspirine.
1. L'aspirine peut-elle être qualifiée de naturelle ?
2. Pourquoi n'utilise-t-on plus l'acide salicylique comme antipyrétique ?
3. A priori, pour quelle raison l'industrie pharmaceutique utilise-t-elle de l'acide salicylique de synthèse plutôt que l'acide salicylique naturel pour fabriquer l'aspirine ?
Histoire des sciences


En 1897, le chimiste allemand Felix Hoffmann (1868-1946) employé par la société Bayer met au point un procédé permettant la synthèse de l'aspirine pure, marquant le début de l'usage de cette molécule comme médicament.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23Équilibrer une équation de réaction
✔ MOD : Écrire une équation de réaction et l'ajuster

L'\alpha-ionone est une molécule présente dans l'essence de violette. On peut la synthétiser en faisant réagir le géranial (\text{C}_{10}\text{H}_{16}\text{O}) et l'acétone (\text{C}_3\text{H}_6\text{O}); la réaction produit également de l'eau.
Sachant que tous les coefficients de l'équation de la réaction sont égaux à 1, établir la formule brute de l'alpha-ionone.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24
La masse volumique en QCM
✔ MATH : Pratiquer le calcul numériqueL'éthanol est un liquide fréquemment employé dans les synthèses. Sa masse volumique est \rho = 0,79 gּ cm-3.
1. Quel volume doit-on mesurer pour prélever m = 20 g d'éthanol ?
2. Quelle est la masse d'un volume V = 5,0 L d'éthanol ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
25Chauffage à reflux
✔ ANA : Justifier un protocole
Un chauffage à reflux peut être mis en place de manière plus simple, selon le schéma ci-dessous.


1.
Identifier le système de chauffage et le système de réfrigération.
2. Pourquoi utilise-t-on un bain-marie au lieu de poser directement l'erlenmeyer sur la plaque ?
3. Ce système n'est pas employé pour des synthèses nécessitant une ébullition. Expliquer pourquoi.
2. Pourquoi utilise-t-on un bain-marie au lieu de poser directement l'erlenmeyer sur la plaque ?
3. Ce système n'est pas employé pour des synthèses nécessitant une ébullition. Expliquer pourquoi.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
26
Comprendre les attendusLe montage à reflux
✔ MOD : Écrire une équation de réaction et l'ajuster
L'éthanoate d'isoamyle (\text{C}_7\text{H}_{14}\text{O}_2) est le principal composant de l'arôme de banane. On l'obtient par synthèse en faisant réagir l'acide éthanoïque (\text{C}_2\text{H}_4\text{O}_2) et l'alcool isoamylique (\text{C}_5\text{H}_{12}\text{O}), que l'on chauffe à reflux durant plusieurs minutes. De l'eau est également produite au cours de cette réaction.
1. Réaliser un schéma légendé du montage.
1. Réaliser un schéma légendé du montage.
Cliquez pour accéder à une zone de dessin
2.
Identifier les réactifs et les produits.
3. Écrire l'équation de la réaction de synthèse de l'éthanoate d'isoamyle.
Détails du barème
3. Écrire l'équation de la réaction de synthèse de l'éthanoate d'isoamyle.
Détails du barème
TOTAL /5,5 pts
1 pts
1.
Réaliser correctement le montage du chauffage à reflux.1 pt
1.
Soigner et légender le schéma.0,5 pt
2.
Identifier les réactifs.0,5 pt
2.
Identifier les produits, y compris l'eau.1,5 pt
3.
Placer correctement les formules des réactifs et
des produits.1 pt
3.
Équilibrer l'équation.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
27Huiles essentielles
✔ APP : Extraire l'information utileSur un catalogue d'huiles essentielles, on trouve un coffret de 5 flacons, dont le descriptif est ci-dessous.
1. Relever dans le texte les arguments de vente qui mettent en avant l'aspect naturel du produit.
2. Observer l'étiquette de l'un de ces flacons (ci-dessus) : ces huiles essentielles sont-elles sans danger ?
3. Comment expliquer qu'un produit de bien-être puisse présenter ces dangers ?
Synérgie d'huiles essentielles


Un coffret complet pour prendre soin de soi au naturel. Cinq mélanges d'huiles essentielles biologiques, justement dosés et prêts à l'emploi, idéal pour profiter des nombreuses vertus des huiles essentielles naturelles.
D'après
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
28
Utilisation d'une ampoule de coulée
✔ REA : Respecter les règles de sécurité✔ ANA : Extraire l'information utile
La butanone est une molécule qu'on trouve dans certains végétaux et dans le lait. On la synthétise en grande quantité pour la fabrication de certaines colles selon la réaction suivante :
butanol + eau de Javel \rightarrow butanone + acide chlorhydrique.
Pour mener à bien cette réaction, on utilise le montage suivant qui contient une ampoule de coulée par laquelle l'eau de Javel est introduite goutte à goutte.

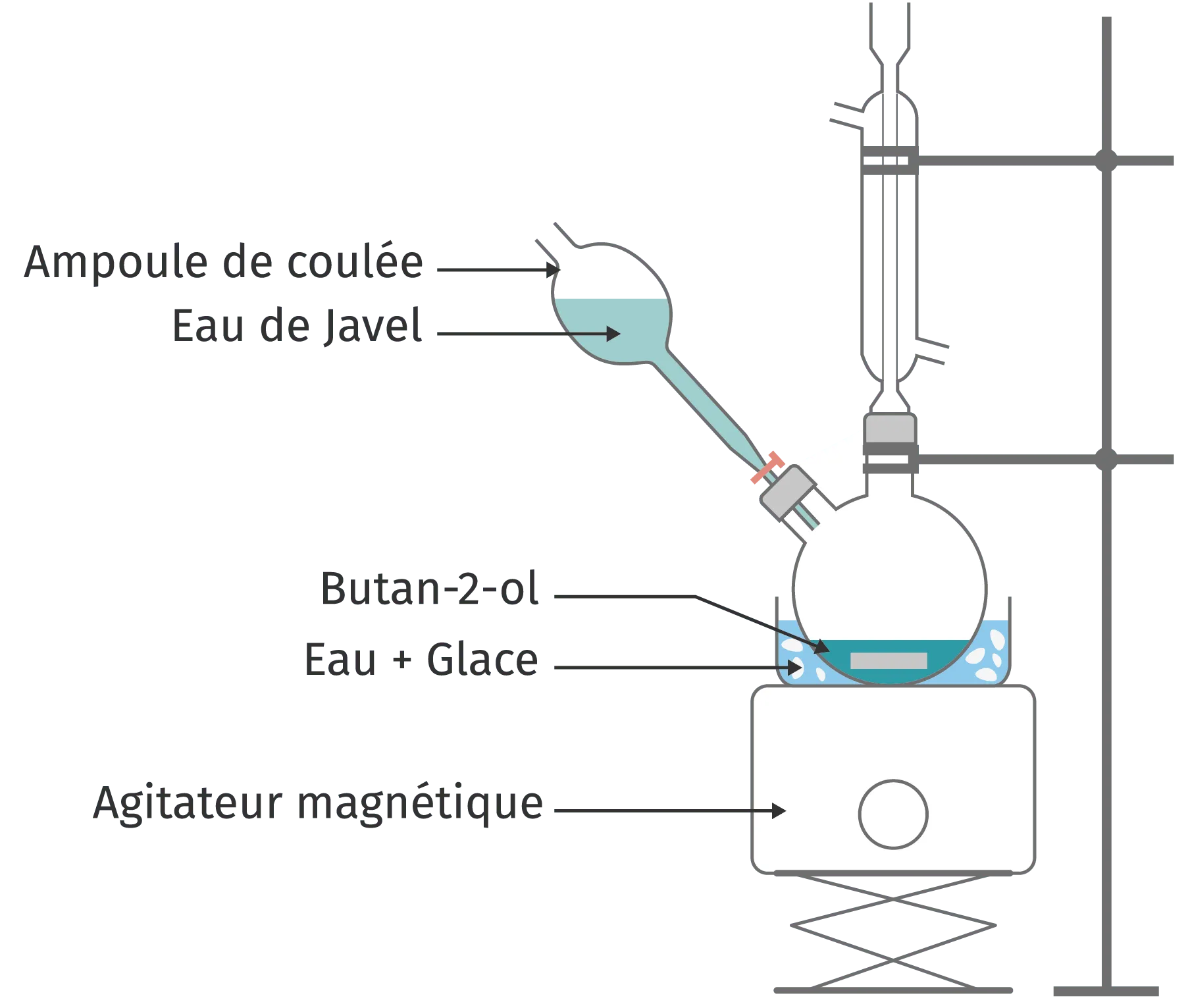
1. Que signifie le terme exothermique ?
2. Pour quelle raison utilise-t-on un bain de glace et un réfrigérant dans cette synthèse ?
3. Justifier l'emploi de l'ampoule de coulée.
Informations sur l'eau de Javel concentrée
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
29Une extraction récalcitrante !
✔ REA : Mettre en œuvre un protocoleLe camphre, utilisé pour soulager les douleurs musculaires, peut être synthétisé en laboratoire. Pour séparer le camphre du milieu réactionnel, on réalise une extraction liquide/liquide. Théo s'étonne que le liquide de son ampoule à décanter (ci-dessous) ne coule plus.

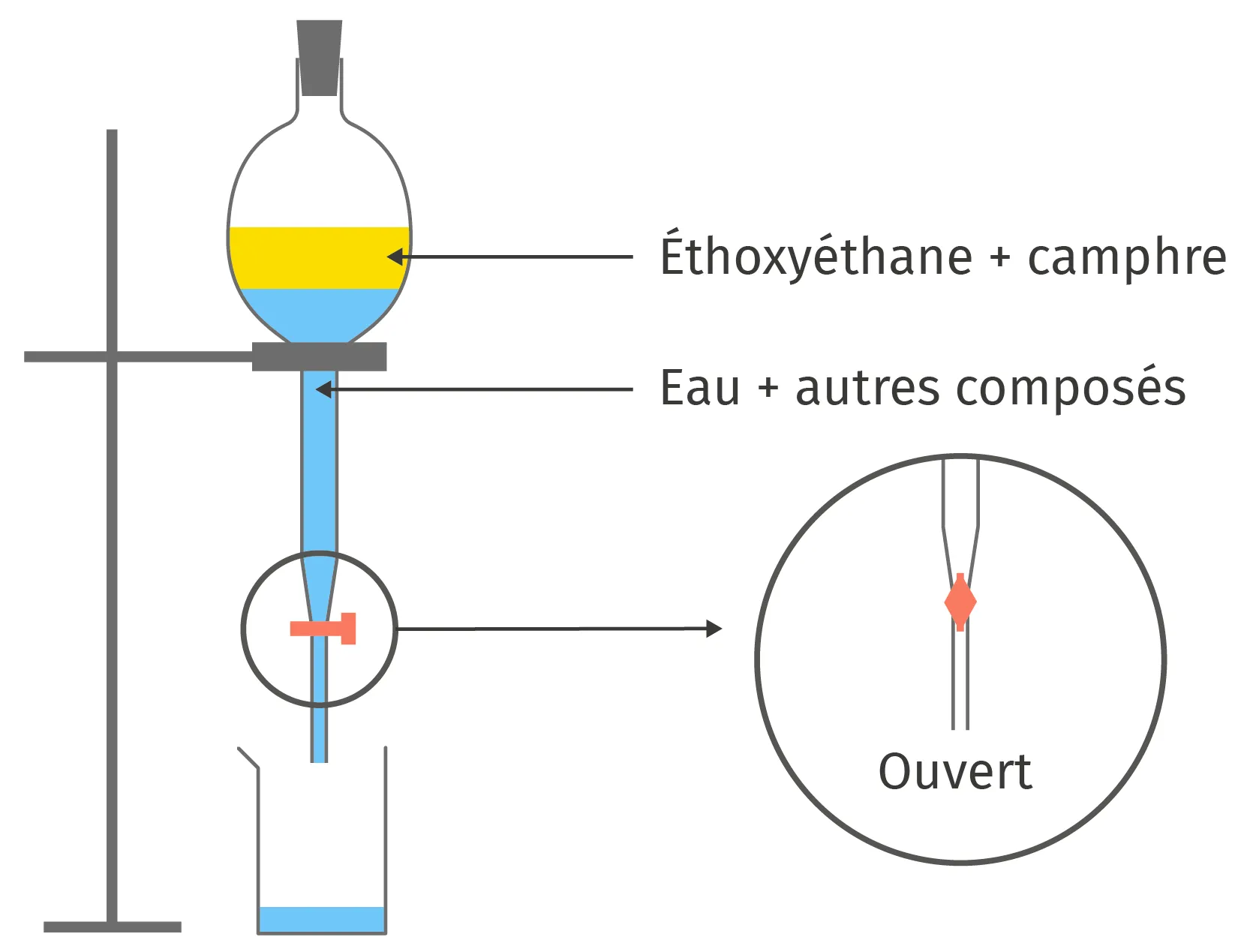
Donner une explication et proposer une solution.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
30
Copie d'élève à commenter
Proposer une justification pour chaque erreur relevée par le correcteur.
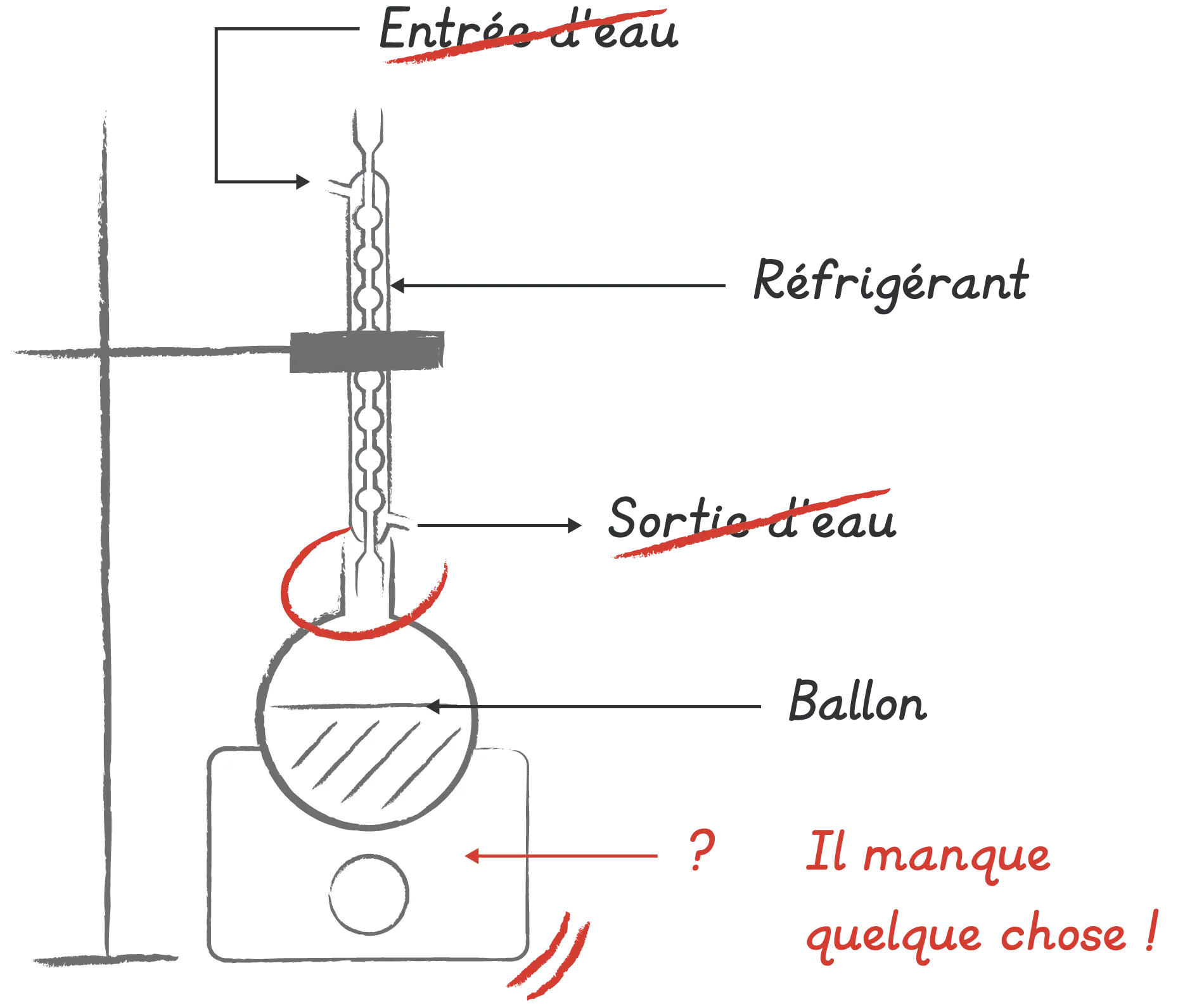
1
2
3
4
5
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
31Additifs des bonbons
✔ APP : Extraire l'information utile
Les bonbons Dragibus contiennent les colorants suivants : E100, E131, E153, E160a, E163.




1. Chercher le nom de ces colorants. Préciser s'ils sont d'origine naturelle ou synthétiques.
2. Peut-on dire que ces bonbons sont artificiels ? Justifier.
2. Peut-on dire que ces bonbons sont artificiels ? Justifier.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
32Violet de gentiane
✔ MOD : Écrire une équation de réaction et l'ajusterLe violet de gentiane, naturellement présent dans certaines plantes, peut être synthétisé en laboratoire à partir de la diméthylaniline et de tétrachlorométhane. Voici une partie du protocole à suivre : sous hotte aspirante, introduire dans un erlenmeyer 10 mL de diéthylamine et 10 mL de tétrachlorométhane. Agiter durant 5 minutes. Filtrer le contenu de l'erlenmeyer pour récupérer le produit obtenu.
1.
Au cours de la réaction, un second produit est formé : le chlorure d'hydrogène \text{HCl}. Écrire l'équation de la réaction puis l'équilibrer.
2. Les réactifs doivent-ils être manipulés en prenant des précautions particulières ? Justifier.
3. Cette synthèse doit se faire sous hotte aspirante, expliquer pourquoi.
2. Les réactifs doivent-ils être manipulés en prenant des précautions particulières ? Justifier.
3. Cette synthèse doit se faire sous hotte aspirante, expliquer pourquoi.
4.
Calculer la masse des deux réactifs introduits.
5. Par quel procédé sépare-t-on le produit du reste du mélange réactionnel ? Justifier le choix de cette méthode.
6. Le violet de gentiane lui-même présente-t-il des risques pour la santé ? À l‘aide des informations complémentaires ci-dessous, justifier que son usage habituel peut se faire sans danger particulier.
5. Par quel procédé sépare-t-on le produit du reste du mélange réactionnel ? Justifier le choix de cette méthode.
6. Le violet de gentiane lui-même présente-t-il des risques pour la santé ? À l‘aide des informations complémentaires ci-dessous, justifier que son usage habituel peut se faire sans danger particulier.
Données
| Espèce chimique | Formule | T_{\text{fusion}} (en °C) | \rho (kg·L-1) |
Sécurité |
|
Diméthylaniline | \text{C}_8\text{H}_{11}\text{N} | 2 |
0,956 |
  |
|
Tétrachlorométhane | \text{CCl}_4 | -23 |
1,594 |
  |
|
Violet de gentiane | \text{C}_{25}\text{H}_{30}\text{N}_3\text{Cl} | 215 |
   | |
|
Chlorure d'hydrogène | \text{HCl} | Gazeux à température ordinaire |
   | |
Complément

Le violet de gentiane est habituellement utilisé en solution à 1 % dans de l'eau alcoolisée (1 g de violet de gentiane dans 99 g de solvant) pour colorer les bactéries afin de les rendre visibles au microscope (une goutte de colorant pour une lame de microscope).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
33Suivi d'une réaction par CCM
✔ ANA : Justifier un protocoleL'acide benzoïque (E210) est un conservateur naturellement présent dans certaines plantes. On peut le synthétiser en faisant réagir l'alcool benzylique avec les ions permanganate.
Pour suivre l'évolution de la transformation, on prélève une goutte du mélange réactionnel toutes les 15 min, que l'on dépose sur une plaque de CCM. Au bout de 90 min, on stoppe le chauffage, puis on plonge la plaque de CCM dans l'éluant. On obtient le chromatogramme ci-dessous où P et R sont des dépôts témoins.

1. Identifier les espèces chimiques présentes dans le mélange au début de la réaction.
2. Observer le chromatogramme : comment interpréter l'évolution de la tache haute et de la tache basse ?
3. Aurait-on pu arrêter le chauffage plus tôt ? Justifier.
Données
- R : réactif (alcool benzylique ) ;
- P : produit (acide benzoïque) ;
- t_1\text{,}\: t_2\text{,} etc. : temps des prélèvements dans le mélange réactionnel.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
34Comparer les arômes
✔ ANA : Justifier un protocole

Iris souhaite comparer deux arômes : l'arôme de vanille naturel (extrait de la gousse) et un arôme de vanille identique au naturel, contenant de la vanilline de synthèse.
Voici le chromatogramme qu'elle obtient :

1. Comment interpréter les différentes taches laissées par la migration de l'arôme naturel ?
2. L'arôme de synthèse est-il vraiment identique à l'arôme naturel ? Pourquoi conserve-t-on cette appellation « identique au naturel » ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AHuile essentielle d'orange
✔ APP : Extraire l'information utile
L'huile essentielle d'orange est obtenue par hydrodistillation de l'écorce d'orange. Le schéma de ce montage est donné ci-après. On obtient alors deux phases, une phase aqueuse et une phase organique. La phase organique constitue l'huile essentielle d'orange. Elle a une densité de 0,85 et contient 91 à 97 % de limonène. Cependant, la chromatographie a permis d'identifier 14 autres composés.

L'huile essentielle d'orange est obtenue par hydrodistillation de l'écorce d'orange. Le schéma de ce montage est donné ci-après. On obtient alors deux phases, une phase aqueuse et une phase organique. La phase organique constitue l'huile essentielle d'orange. Elle a une densité de 0,85 et contient 91 à 97 % de limonène. Cependant, la chromatographie a permis d'identifier 14 autres composés.

1. Légender le schéma.
2. L'huile essentielle d'orange est-elle un corps pur ?
3. À l'issue de l'hydrodistillation, quelle phase se trouve en haut ?
4. La phase aqueuse contient aussi un peu de limonène. On souhaite récupérer également le limonène présent dans cette phase.
a. Quel solvant doit-on utiliser pour réaliser cette extraction liquide-liquide ?
b. Pour séparer le limonène du solvant extracteur, on veut évaporer le solvant sans évaporer le limonène. À quelle température doit-on se placer ?
2. L'huile essentielle d'orange est-elle un corps pur ?
3. À l'issue de l'hydrodistillation, quelle phase se trouve en haut ?
4. La phase aqueuse contient aussi un peu de limonène. On souhaite récupérer également le limonène présent dans cette phase.
a. Quel solvant doit-on utiliser pour réaliser cette extraction liquide-liquide ?
b. Pour séparer le limonène du solvant extracteur, on veut évaporer le solvant sans évaporer le limonène. À quelle température doit-on se placer ?
Données
| Température de vaporisation (°C) | Solubilité du limonène | Miscibilité avec l'eau | |
|---|---|---|---|
| Limonène | 176 | ||
| Eau | 100 | Très faible | |
| Cyclohexane | 81 | Bonne | Non |
| Ethanol | 79 | Bonne | Oui |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BAcétylcystéine
✔ MOD : Modéliser une transformation chimique
L'acétylcystéine est une molécule utilisée comme fluidifiant dans des médicaments prescrits en cas de toux grasse. On peut la synthétiser en faisant réagir la cystéine (qui est un acide aminé naturel) avec de l'anhydride acétique. On obtient alors l'acétylcystéine et de l'acide acétique.
L'acétylcystéine est une molécule utilisée comme fluidifiant dans des médicaments prescrits en cas de toux grasse. On peut la synthétiser en faisant réagir la cystéine (qui est un acide aminé naturel) avec de l'anhydride acétique. On obtient alors l'acétylcystéine et de l'acide acétique.
1. Sachant que tous les coefficients stoechiométriques de l'équation de cette réaction sont égaux à 1, quelle est la formule brute de l'acétylcystéine ?
2. Quelle masse d'acétylcystéine obtient-on à partir de 100 g de cystéine ?
Données
| Molécule | Formule brute | Masse M d'une mole (g) |
|---|---|---|
| Cystéine | \mathrm{C}_{3} \mathrm{H}_{7} \mathrm{NO}_{2} \mathrm{~S} | 121 |
| Acétylcystéine | 163 | |
| Anhydride acétique | \mathrm{C}_{4} \mathrm{H}_{6} \mathrm{O}_{3} | 102 |
| Acide acétique | \mathrm{C}_{2} \mathrm{H}_{4} \mathrm{O}_{2} | 60 |
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

