Chapitre 9
Exercices
Pour s'échauffer - Pour commencer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
| Pour commencer | Différenciation | Pour s'entraîner | Retour sur la problématique du chapitre | |
|---|---|---|---|---|
| Identifier, dans un protocole, les étapes de transformation des réactifs, d'isolement, de purification et d'analyse (identification, pureté) du produit synthétisé | ||||
| Déterminer, à partir d'un protocole et de données expérimentales, le rendement d'une synthèse | ||||
| Justifier, à partir des propriétés physico-chimiques des réactifs et des produits, le choix des méthodes d'isolement, de purification ou d'analyse | ||||
| Schématiser des dispositifs expérimentaux des étapes d'une synthèse et les légender |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour s'échauffer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
5 Distillation fractionnée
1. Donner le rôle d'une distillation fractionnée lors d'une
synthèse.2. Quel doit être l'état physique de l'espèce chimique formée pour qu'une telle opération soit envisageable ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
6 Mesure d'une température de changement d'état
1. Donner le rôle d'une mesure de la température de
changement d'état du produit à la fin d'une synthèse.2. Avec quel appareil peut-on mesurer une température de fusion ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
7 Chromatographie sur couche mince
Combien de taches doit présenter un chromatogramme à la fin d'une synthèse si le produit obtenu est pur ?Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
8 Légender des schémas
Légender les schémas suivants et indiquer le nom du dispositif correspondant. 
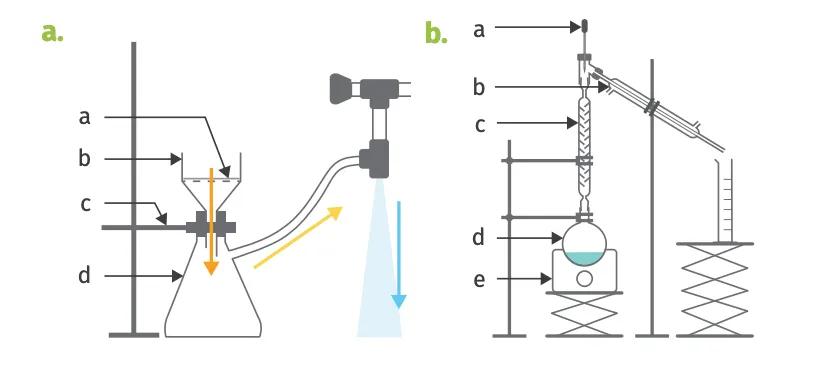
1
2
3
4
5
6
7
8
9
10
11
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
ACalculer un rendement
Déterminer la valeur du rendement de la réaction suivante :
2\text{C}_7\text{H}_6\text{O}\rightarrow \text{C}_{14}\text{H}_{12}\text{O}_2 sachant que l'on a au départ 0,20 mol de benzaldéhyde (\text{C}_7\text{H}_6\text{O}
) et que l'on obtient à la fin de la synthèse 0,07 mol de benzoïne (\text{C}_{14}\text{H}_{12}\text{O}_2
).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour commencer
Les étapes d'une synthèse
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9 Synthèse du cyclohexanol
✔ RAI/ANA : Justifier un protocoleVoici des extraits du protocole expérimental de la synthèse du cyclohexanol par réduction de la cyclohexanone :
- dans un ballon, placer la cyclohexanone, l'éthanol et le réducteur puis laisser réagir durant 20 minutes ;
- verser ensuite le mélange obtenu dans une ampoule à décanter et extraire la phase aqueuse à l'aide d'éther ;
- réaliser une distillation fractionnée de la phase organique après l'avoir lavée et séchée.
1. Identifier les étapes de transformation des réactifs, d'isolement, de purification ou d'analyse du produit.
2. Dans quel état physique se trouve, a priori, le cyclohexanol à la fin de la synthèse ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
10 Synthèse d'une coumarine
✔ RAI/ANA : Justifier un protocoleVoici des extraits du protocole expérimental de la synthèse d'un anticoagulant :
- placer dans un ballon les deux réactifs et l'éthanol puis réaliser un dispositif de chauffage à reflux ;
- laisser le mélange à reflux pendant 20 minutes puis procéder à une filtration sous vide ;
- après avoir séché le solide obtenu, mesurer sa température de fusion.
1. Identifier les étapes de transformation des réactifs, d'isolement, de purification ou d'analyse du produit.
2. Quelle(s) étape(s) aurait-on pu ajouter pour améliorer la pureté du produit synthétisé ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Analyse du produit obtenu
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11 Synthèse de l'eugénol
✔ RAI/ANA : Justifier un protocoleAprès une synthèse, on réalise une CCM et on obtient le chromatogramme ci-dessus. Le dépôt A correspond à l'eugénol commercial et le dépôt B au produit obtenu.

2. Le composé obtenu est-il pur ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
12 Identification et pureté d'un composé
✔ RAI/ANA : Justifier un protocoleOn souhaite réaliser la synthèse de l'éthanal \mathrm{CH}_{3} \mathrm{CHO} par oxydation de l'éthanol \mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{OH}. Après réaction puis traitement, on isole le produit qui est ensuite analysé par spectroscopie infrarouge. Le spectre obtenu est représenté ci-dessous.

Répondre aux questions suivantes en s'aidant si besoin des tables IR
.
1. Montrer que la réaction a effectivement eu lieu.
2. Reste-t-il de l'éthanol ? Quelle différence y aurait-il sur le spectre dans le cas contraire ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Élaboration de protocoles
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
13 Première étape de la fabrication d'un savon
✔ RAI/ANA : Justifier un protocolePour réaliser la synthèse d'un savon, on chauffe à reflux pendant 30 min un mélange constitué d'oléine, d'hydroxyde de sodium (soude), d'éthanol et de quelques grains de pierre ponce. On transvase le mélange obtenu dans un bécher contenant de l'eau salée.
1.
Représenter le schéma du montage utilisé pour la première étape et le légender.
2. Quels sont les deux intérêts d'un tel montage ?
Cliquez pour accéder à une zone de dessin
2. Quels sont les deux intérêts d'un tel montage ?
3.
Quel est le rôle de l'éthanol ? De la pierre ponce ?
4. Représenter et légender le schéma du montage utilisé pour la filtration.
4. Représenter et légender le schéma du montage utilisé pour la filtration.
Cliquez pour accéder à une zone de dessin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
| Propriété/espèce | Oléine | Soude | Savon |
|---|---|---|---|
| Solubilité dans l'eau | Insoluble | Soluble | Soluble |
| Solubilité dans l'éthanol | Soluble | Soluble | - |
| Solubilité dans l'eau salée | Insoluble | Soluble | Peu soluble |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une notion, trois exercices
Différenciation
Savoir‑faire : Déterminer, à partir d'un protocole et de données expérimentales, le rendement d'une synthèse
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
14 Rendement d'un produit solide
✔ RAI/MOD : Modéliser une transformation chimiqueOn fait réagir 5,0 \times 10-2 mol de géraniol \mathrm{C}_{10} \mathrm{H}_{18} \mathrm{O} et 6,0 \times 10-2 mol d'acide éthanoïque \mathrm{C}_{2} \mathrm{H}_{4} \mathrm{O}_{2}. Après traitement, on isole 6,9 g d'éthanoate de géranyle \mathrm{C}_{12} \mathrm{H}_{20} \mathrm{O}_{2}.
1. Déterminer la quantité de matière maximale de produit qui aurait pu être synthétisée.
2. En déduire le rendement de la réaction.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Équation de la réaction :
\mathrm{C}_{10} \mathrm{H}_{18} \mathrm{O}+\mathrm{C}_{2} \mathrm{H}_{4} \mathrm{O}_{2} \leftrightarrows \mathrm{C}_{12} \mathrm{H}_{20} \mathrm{O}_{2}+\mathrm{H}_{2} \mathrm{O} ; - Masse molaire de l'éthanoate de géranyle :
M= 196,3 g·mol-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15 Rendement d'un produit liquide
✔ RAI/MOD : Modéliser une transformation chimiqueOn réalise la synthèse de l'éthanoate d'isoamyle \mathrm{C}_{7} \mathrm{H}_{14} \mathrm{O}_2 à partir de 20 mL d'alcool isoamylique \mathrm{C}_{5} \mathrm{H}_{12} \mathrm{O} et de 15 mL d'acide éthanoïque \mathrm{C}_{2} \mathrm{H}_{4} \mathrm{O}_{2}.
On obtient un volume d'ester égal à 20,4 mL.
1. Calculer les quantités de matière de chacun des réactifs et montrer que l'acide acétique est en excès.
2. Déterminer la valeur du rendement de cette synthèse.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Équation de la réaction :
\mathrm{C}_{5} \mathrm{H}_{12} \mathrm{O}+\mathrm{C}_{2} \mathrm{H}_{4} \mathrm{O}_{2} \rightleftarrows \mathrm{C}_{7} \mathrm{H}_{14} \mathrm{O}_{2}+\mathrm{H}_{2} \mathrm{O} ; - M_{\text {acide acétique}}= 60,0 g·mol-1 ;
- M_{\text {alcool isoamylique}}= 88,1 g·mol-1 ;
- M_{\text {éthanoate d'isoamyle}}= 130,2 g·mol-1 ;
- \rho_{\text {acide acétique}}= 1,05 g·mL-1 ;
- \rho_{\text {alcool isoamylique}}= 0,81 g·mL‑1 ;
- \rho_{\text {éthanoate d'isoamyle}}= 0,86 g·mL‑1 ;
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
16 Élaboration d'un protocole
✔ RAI/MOD : Modéliser une transformation chimiqueOn souhaite synthétiser 10 g de benzoate de méthyle \mathrm{C}_{8} \mathrm{H}_{8} \mathrm{O}_{2} à partir d'acide benzoïque \mathrm{C}_{7} \mathrm{H}_{6} \mathrm{O}_{2} et de méthanol \mathrm{CH}_{4} \mathrm{O}.
Sachant que cette synthèse a un rendement de 70 %, déterminer le volume minimal de méthanol et la masse minimale d'acide benzoïque à utiliser.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Équation de la réaction :
\mathrm{C}_{7} \mathrm{H}_{6} \mathrm{O}_{2}+\mathrm{CH}_{4} \mathrm{O} \rightleftarrows \mathrm{C}_{8} \mathrm{H}_{8} \mathrm{O}_{2}+\mathrm{H}_{2} \mathrm{O} ; - M_{\text {acide benzoïque}}= 122,1 g·mol‑1 ;
- M_{\text {méthanol}}= 32,0 g·mol-1 ;
- M_{\text {benzoate de méthyle}}= 136,1 g·mol-1 ;
- \rho_{\text {acide benzoïque}}= 1,27 g·mL -1 ;
- \rho_{\text {méthanol}}= 0,79 g·mL-1
- \rho_{\text {benzoate de méthyle}}= 1,10 g·mL-1 ;
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

