Chapitre 9
Exercice corrigé
Éphédrine et hordénine
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Énoncé
Compétence(s)
APP : Maîtriser le vocabulaire du cours
APP : Faire un schéma
APP : Faire un schéma


Ephedra distachya : plante dont est extraite l'éphédrine.
L'éphédrine est utilisée dans divers pays pour le traitement de l'asthme, de l'obésité ou lors d'interventions chirurgicales pour maintenir une pression artérielle suffisamment haute. Proche chimiquement des amphétamines, elle est utilisée à des fins de dopage chez les sportifs de haut niveau. Son usage est donc régulé dans de nombreux pays.
L'hordénine est une molécule analogue extraite de l'orge. En infusion, elle permet de traiter la diarrhée.
1. Déterminer la formule brute de l'éphédrine.
2. Représenter sa formule topologique. Entourer et nommer ses groupes caractéristiques.
3. Préciser combien l'éphédrine possède de doubles liaisons.
4. Déterminer la formule brute et représenter la formule topologique de l'hordénine. Conclure.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1 Modèle moléculaire de l'éphédrine

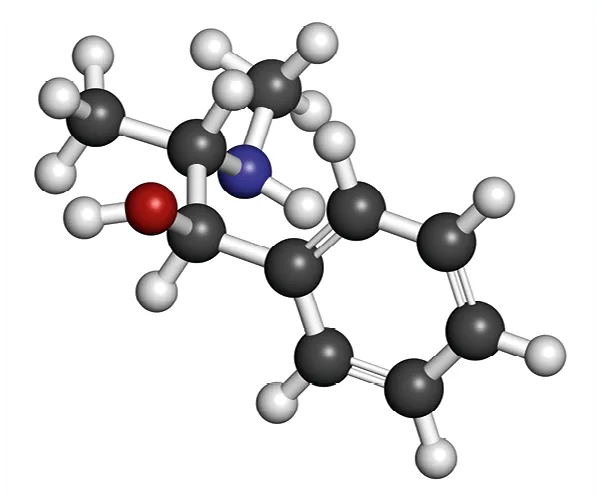
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2 Modèle moléculaire de l'hordénine

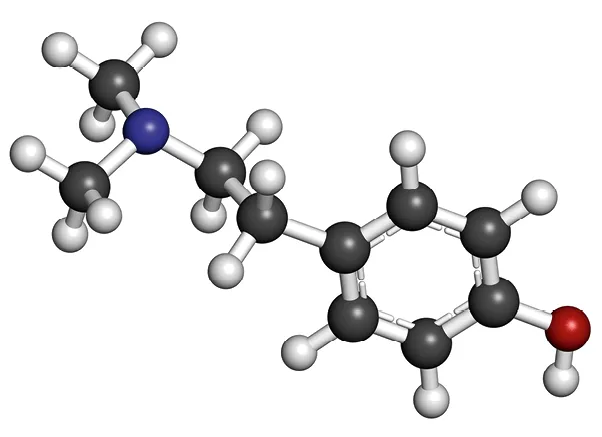
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Solution rédigée
1. La formule brute de l'éphédrine est \text{C}_{10}\text{H}_{15}\text{NO}.
2. La formule topologique de l'éphédrine est :
 L'éphédrine est une molécule polyfonctionnelle.
L'éphédrine est une molécule polyfonctionnelle.
3. L'éphédrine possède trois doubles liaisons, toutes dans le cycle à six atomes du carbone.
4. La formule brute de l'hordénine est \text{C}_{10}\text{H}_{15}\text{NO}. Sa formule topologique est :
 L'hordénine et l'éphédrine ont la même formule brute, mais des formules topologiques différentes. Ce sont donc deux isomères de constitution.
L'hordénine et l'éphédrine ont la même formule brute, mais des formules topologiques différentes. Ce sont donc deux isomères de constitution.
2. La formule topologique de l'éphédrine est :

3. L'éphédrine possède trois doubles liaisons, toutes dans le cycle à six atomes du carbone.
4. La formule brute de l'hordénine est \text{C}_{10}\text{H}_{15}\text{NO}. Sa formule topologique est :

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Protocole de réponse
1. Dénombrer les atomes sur le modèle moléculaire (en noir les atomes de carbone, en rouge les atomes d'oxygène, en bleu les atomes d'azote et en blanc les atomes d'hydrogène).
2. S'aider du modèle moléculaire fourni.
Reconnaître les différents groupes caractéristiques et leur famille associée.
Repérer la présence de groupes caractéristiques.
Déterminer les familles associées.
3. Repérer les insaturations à la présence de liaisons multiples (double ou triple) ou d'un cycle.
4. Comparer les formules brutes et les formules topologiques des deux molécules.
2. S'aider du modèle moléculaire fourni.
Reconnaître les différents groupes caractéristiques et leur famille associée.
Repérer la présence de groupes caractéristiques.
Déterminer les familles associées.
3. Repérer les insaturations à la présence de liaisons multiples (double ou triple) ou d'un cycle.
4. Comparer les formules brutes et les formules topologiques des deux molécules.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Mise en application
Découvrez l' pour travailler cette notion.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

