Chapitre 4
Exercices
Pour s'échauffer - Pour commencer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour s'échauffer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
5Vitesse volumique
On étudie la réaction dont l'équation est la suivante :5 \ \text{Br}^-(\text{aq}) + \text{BrO}^-_3(\text{aq}) + 6 \ \text{H}^+(\text{aq}) \rightarrow \ 3 \ \text{Br}_2(\text{aq}) + 3 \ \text{H}_2\text{O}(\text{l})
Cette réaction est réalisée à \text{pH} constant, avec des ions bromure \text{Br}^-(\text{aq}) en excès. Dans ces conditions, la réaction est d'ordre 1 par rapport aux ions bromate \text{BrO}^-_3(\text{aq}).
Calculer la vitesse volumique initiale de disparition des ions bromate \text{BrO}^-_3(\text{aq}) sachant que k = 5{,}0 \times 10^{-4} s-1 et [\text{BrO}^-_3]_0 = 1{,}0 \times 10^{-3} mol·L-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
6Intermédiaire réactionnel
Citer l'intermédiaire réactionnel présent dans le mécanisme suivant :
- \text{C}_4\text{H}_9\text{Br}(\text{aq}) \rightarrow \ \text{C}_4\text{H}^+_9(\text{aq}) + \text{Br}^-(\text{aq})
- \text{C}_4\text{H}^+_9(\text{aq}) + \text{HO}^-(\text{aq}) \rightarrow \ \text{C}_4\text{H}_8(\text{aq}) + \text{H}_2\text{O}(\text{l})
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
7Facteur cinétique
En considérant le graphique ci-dessous, représenter l'allure de la courbe si l'on diminuait la température du milieu réactionnel.

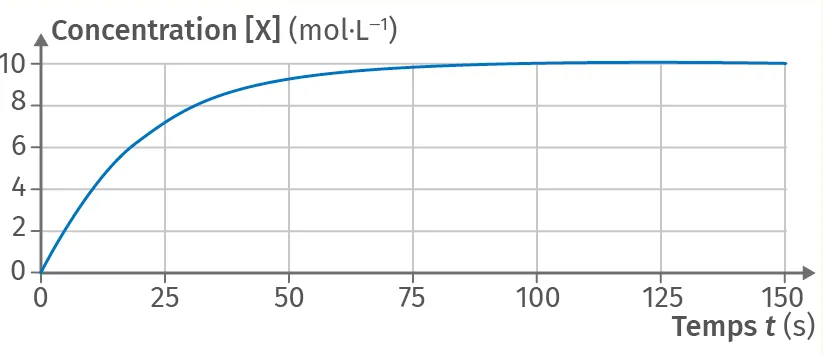
Doc
Évolution temporelle d'une concentration


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
8Temps de demi-réaction
D'après le graphique de l', déterminer le temps de demi-réaction t_{1/2}.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour commencer
Vitesse volumique
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9Suivi de réaction
✔ APP : Faire des prévisions à l'aide d'un modèle
On s'intéresse à la réaction entre le diiode \text{I}_2(\text{aq}) jaune et le dihydrogène \text{H}_2(\text{aq}) incolore, solubilisé par un barbotage du gaz \text{H}_2(\text{g}) :
\text{H}_2(\text{aq}) + \text{I}_2(\text{aq}) \rightarrow \ 2\ \text{H}^+(\text{aq}) + 2\ \text{I}^-(\text{aq})
1. Proposer un ou plusieurs capteurs adaptés pour
suivre l'évolution temporelle de cette transformation.
2. Pour chaque capteur, préciser comment évoluerait la grandeur suivie.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
10Température comme facteur cinétique
✔ APP : Extraire l'information utile
Les ions peroxodisulfate \text{S}_2\text{O}^{2-}_8(\text{aq}) oxydent les ions iodure \text{I}^-(\text{aq}) selon une transformation totale. On précise que ces deux espèces chimiques appartiennent aux couples d'oxydoréduction \text{S}_2\text{O}^{2-}_8(\text{aq}) / \text{SO}^{2-}_4(\text{aq}) et \text{I}_3^-(\text{aq}) / \text{I}^-(\text{aq}).
1. Écrire l'équation de la réaction.
2. D'après le doc. ci-dessous, justifier que la température est un facteur cinétique et préciser son influence.
3. Déterminer graphiquement le temps de demiréaction t_{1/2} à 297 K.
2. D'après le doc. ci-dessous, justifier que la température est un facteur cinétique et préciser son influence.
3. Déterminer graphiquement le temps de demiréaction t_{1/2} à 297 K.
Doc
Concentration en ion \text{S}_2\text{O}^{2-}_8(\text{aq})

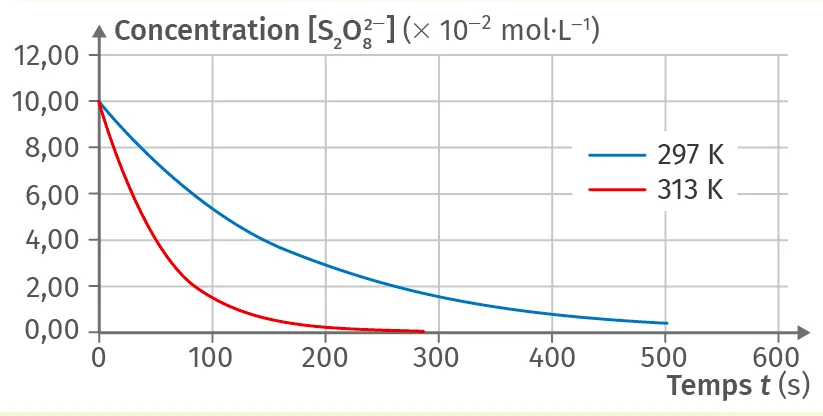
Le graphe représente l'évolution temporelle de la concentration en ion \text{S}_2\text{O}^{2-}_8(\text{aq}) pour différentes températures du milieu réactionnel.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11Ordre et température
✔ VAL : Analyser des résultats
Un étudiant sort d'une séance de travaux pratiques, la tête un peu ailleurs, avec pour tâche de terminer le compte-rendu pour le lendemain. Ce TP est très important pour son cursus et, avec le stress, il constate qu'il a mélangé tous ses résultats et a perdu les valeurs des constantes de vitesses associées à ses courbes. Il a réalisé la même réaction, mais à trois températures différentes (T_1 \lt T_2 \lt T_3).

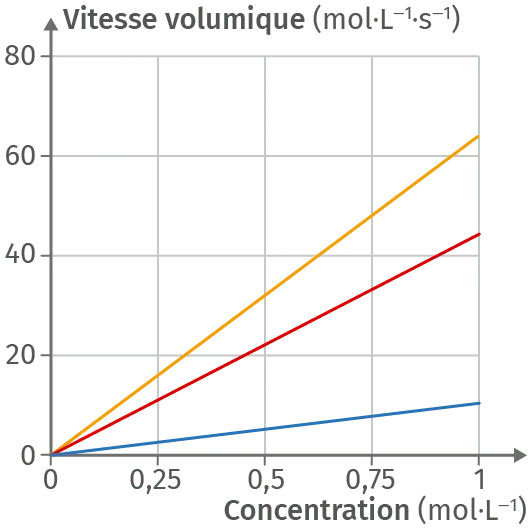
1. Justifier que la réaction suit une loi d'ordre 1.
2. Déterminer chaque constante de vitesse k sachant qu'il s'agit du coefficient directeur de la droite liant vitesse volumique de disparition et concentration du réactif.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Mécanisme
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
12Estérification
✔ REA : Utiliser un modèle
L'estérification est une réaction chimique couramment employée, permettant la fabrication d'esters. On s'intéresse à la cinétique de l'estérification de l'éthanoate d'éthyle à l'odeur fruitée, dont on présente les deux premières étapes du mécanisme réactionnel.

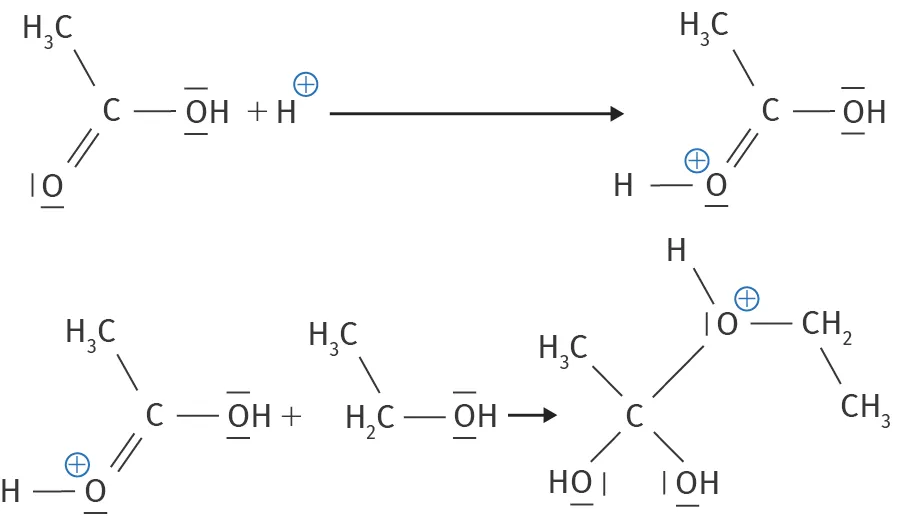


1. Cliquer sur les formules et ajouter les lacunes électroniques d'après les règles de Lewis grâce à l'outil « dessin ».
2. Représenter les flèches courbes du mécanisme.
3. Identifier un intermédiaire réactionnel.
4. Au terme de trois autres actes élémentaires, l'ion \text{H}^+ est reformé. Qualifier cette espèce.
2. Représenter les flèches courbes du mécanisme.
3. Identifier un intermédiaire réactionnel.
4. Au terme de trois autres actes élémentaires, l'ion \text{H}^+ est reformé. Qualifier cette espèce.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
13Formalisme de la flèche courbe
✔ APP : Formuler des hypothèses
Dessiner sur ce mécanisme réactionnel les deux flèches courbes nécessaires. Pour cela, cliquer sur l'image et utiliser l'outil « dessin ».
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
14Savons
✔ RAI/MOD : Modéliser une transformation


La transformation suivante est une saponification permettant de produire un anion à la base de certains savons. Il s'agit de l'un des mécanismes réactionnels les plus étudiés en cinétique chimique.

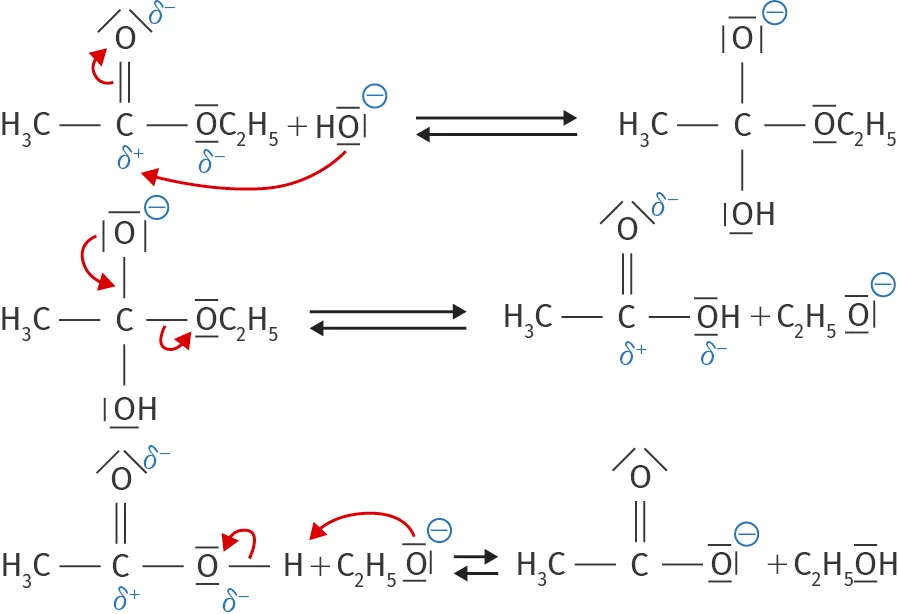


1. Dénombrer les actes élémentaires.
2. Identifier deux intermédiaires réactionnels.
3. Écrire l'équation-bilan de cette réaction.
2. Identifier deux intermédiaires réactionnels.
3. Écrire l'équation-bilan de cette réaction.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15Chloration du chloroforme
✔ APP : Maîtriser le vocabulaire du cours
On présente le mécanisme réactionnel de chloration du chloroforme \text{CCl}_4(\text{aq}). Il s'agit d'une réaction radicalaire, car elle fait intervenir \text{Cl}^{\bullet}(\text{aq}), une espèce très instable, appelée radical. Cette espèce est produite par la décomposition de \text{Cl}_2(\text{aq}) sous l'effet de la lumière.
- \text{Cl}_2(\text{aq}) \rightarrow \ 2\ \text{Cl}^{\bullet}(\text{aq}) (initiation)
- \text{Cl}^{\bullet}(\text{aq}) + \text{CHCl}_3(\text{aq}) \rightarrow \ \text{HCl}(\text{aq}) + \text{CCl}^{\bullet}_3(\text{aq})
- \text{CCl}^{\bullet}_3(\text{aq}) + \text{Cl}_2(\text{aq}) \rightarrow \ \text{CCl}_4(\text{aq}) + \text{Cl}^{\bullet}(\text{aq})
- 2\ \text{Cl}^{\bullet}(\text{aq}) \rightarrow \ \text{Cl}_2(\text{aq}) (terminaison)
1. Identifier le ou les intermédiaires réactionnels.
2. Identifier le facteur cinétique.
3. Écrire l'équation-bilan de cette réaction.
2. Identifier le facteur cinétique.
3. Écrire l'équation-bilan de cette réaction.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
16Décomposition de l'ozone
✔ APP : Maîtriser le vocabulaire du cours
L'ozone stratosphérique \text{O}_3(\text{g}), sous l'effet de la lumière, peut se décomposer en dioxygène \text{O}_2(\text{g}) selon le mécanisme réactionnel suivant :
Ce mécanisme est très lent et fait intervenir une espèce très instable \text{O}^{\bullet}(\text{g}), dite radicalaire. Le dichlore \text{Cl}_2(\text{g}) catalyse cette réaction selon le mécanisme suivant :
L'espèce chimique \text{ClO}(\text{g}) est détruite par d'autres réactions.
- \text{O}_3(\text{g}) \rightarrow \ \text{O}_2(\text{g}) + \text{O}^{\bullet}(\text{g})
- \text{O}_3(\text{g}) + \text{O}^{\bullet}(\text{g}) \rightarrow \ 2\ \text{O}_2(\text{g})
Ce mécanisme est très lent et fait intervenir une espèce très instable \text{O}^{\bullet}(\text{g}), dite radicalaire. Le dichlore \text{Cl}_2(\text{g}) catalyse cette réaction selon le mécanisme suivant :
- \text{Cl}_2(\text{g}) + \text{O}_3(\text{g}) \rightarrow \ \text{ClO}(\text{g}) + \text{ClO}_2(\text{g})
- \text{ClO}_2(\text{g}) + \text{O}_3(\text{g}) \rightarrow \ \text{ClO}_3(\text{g}) + \text{O}_2(\text{g})
- \text{ClO}_3(\text{g}) + \text{O}_3(\text{g}) \rightarrow \ \text{ClO}_2(\text{g}) + 2\ \text{O}_2(\text{g})
- 2\ \text{ClO}_3(\text{g}) \rightarrow \ \text{Cl}_2(\text{g}) + 3\ \text{O}_2(\text{g})
L'espèce chimique \text{ClO}(\text{g}) est détruite par d'autres réactions.
1. Écrire l'équation-bilan de la décomposition de
l'ozone \text{O}_3(\text{g}) correspondant au premier mécanisme réactionnel.
2. Identifier le catalyseur dans le second mécanisme réactionnel.
3. Repérer les intermédiaires réactionnels apparaissant dans les deux mécanismes.


2. Identifier le catalyseur dans le second mécanisme réactionnel.
3. Repérer les intermédiaires réactionnels apparaissant dans les deux mécanismes.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une notion, trois exercicesDifférenciation
Savoir déterminer un temps de demi-réaction
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
La concentration d'un gaz est égale au rapport entre la quantité de matière de ce gaz et le volume de l'enceinte.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17Décomposition du pentoxyde d'azote (1)
✔ APP : Extraire l'information utile
À l'aide du graphique, déterminer le temps de demi‑réaction t_{1/2} de la décomposition du pentoxyde d'azote \text{N}_2\text{O}_5(\text{g}) en dioxygène \text{O}_2(\text{g}) à 1 200 K.

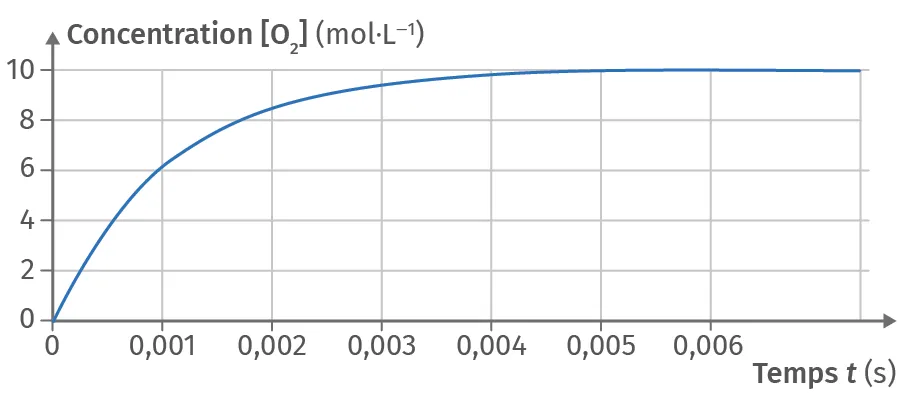
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
18
Décomposition du pentoxyde d'azote (2)
✔ APP : Extraire l'information
Le pentoxyde d'azote \text{N}_2\text{O}_5(\text{g}) se décompose selon la réaction d'équation suivante :
1. Dresser le tableau d'avancement de la décomposition du pentoxyde d'azote \text{N}_2\text{O}_5(\text{g}) en dioxygène \text{O}_2(\text{g}) et en dioxyde d'azote \text{NO}_2(\text{g}) à 500 K.
2\ \text{N}_2\text{O}_5(\text{g}) \rightarrow \ 4\ \text{NO}_2(\text{g}) + \text{O}_2(\text{g})
1. Dresser le tableau d'avancement de la décomposition du pentoxyde d'azote \text{N}_2\text{O}_5(\text{g}) en dioxygène \text{O}_2(\text{g}) et en dioxyde d'azote \text{NO}_2(\text{g}) à 500 K.
| Avancement | \rightarrow | + | ||||
| État initial | x=0 mol | |||||
| État intermédiaire | x | |||||
| État final | x_\text{max} | |||||
2. D'après la représentation graphique fournie,
déterminer le temps de demi-réaction t_{1/2} de la décomposition du pentoxyde d'azote \text{N}_2\text{O}_5(\text{g}) à 500 K.

Donnée
- Concentration initiale : [\text{N}_2\text{O}_5]_0 = 0{,}125 mol·L-1
- Volume total de l'enceinte : V = 1{,}00 L


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
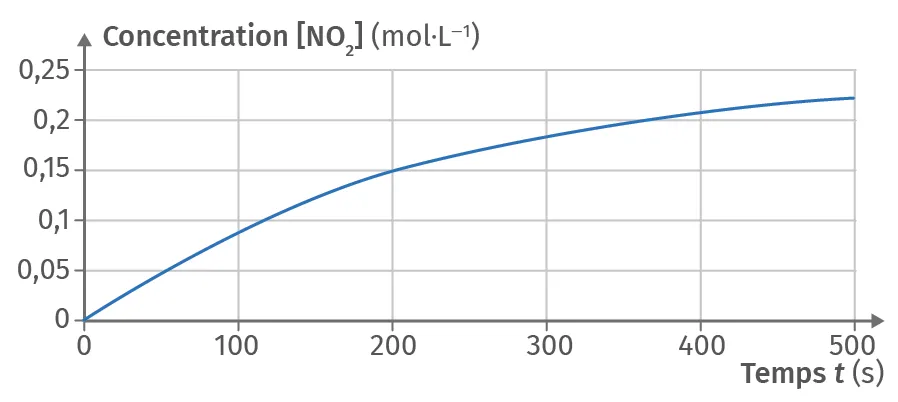
19Décomposition du pentoxyde d'azote (3)
✔ APP : Extraire l'information
Le pentoxyde d'azote \text{N}_2\text{O}_5(\text{g}) se décompose selon la réaction d'équation :
2\ \text{N}_2\text{O}_5(\text{g}) \rightarrow \ 4\ \text{NO}_2(\text{g}) + \text{O}_2(\text{g})
1. Dresser le tableau d'avancement sachant que la concentration initiale en pentoxyde d'azote est égale à 1,00 mol·L-1 et le volume de l'enceinte égal à 1,0 L.
| Avancement | \rightarrow | + | ||||
| État initial | x=0 mol | |||||
| État intermédiaire | x | |||||
| État final | x_\text{max} | |||||
2. Tracer le graphique correspondant à l'évolution de la concentration en dioxygène \text{O}_2(\text{g}) en fonction du temps d'après le tableau suivant :
| t (× 10-3 s) | >0 | 2,0 | 4,0 | 6,0 |
| [\text{O}_2] mol·L-1 | 0 | 0,15 | 0,26 | 0,33 |
3. Déterminer le temps de demi-réaction t_{1/2} de la réaction à 1 000 K.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

