Chapitre 4
Exercice corrigé
Sucre dans une canette
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Énoncé
Compétence(s)
VAL : Analyser des résultats
RAI/ANA : Modéliser une transformation
RAI/ANA : Modéliser une transformation


La composition d'une canette de soda indique que la boisson contient 35 g de sucre pour 330 mL. Le nom scientifique du sucre est le saccharose, de formule brute \text{C}_{12}\text{H}_{22}\text{O}_{11}. Le saccharose se dégrade au contact de l'eau pour former deux autres sucres, le fructose et le glucose, chacun de formule brute \text{C}_6\text{H}_{12}\text{O}_6.
| Temps t (s) | 0 | 0,5 × 106 | 1,0 × 106 | 2,0 × 106 | 2,5 × 106 |
| Concentration en fructose [\text{C}_6\text{H}_{12}\text{O}_6] (mol·L‑1) | 0 | 7,6 × 10-2 | 1,3 × 10-1 | 2,1 × 10-1 | 2,3 × 10-1 |
1. Donner l'équation de dégradation de la réaction du saccharose avec l'eau.
2. Calculer la quantité de saccharose dans une canette. En déduire la concentration finale en fructose.
3. Tracer le graphique représentant l'évolution de la concentration de fructose au cours du temps.
4. À partir de la concentration finale en fructose, déterminer le temps de demi-réaction t_{1/2}.
5. Conclure en convertissant t_{1/2} dans une unité adaptée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Données
- Masses molaires :
- M(\text{C}) = 12{,}0 g·mol-1
- M(\text{H}) = 1{,}0 g·mol-1
- M(\text{O}) = 16{,}0 g·mol-1
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Protocole de réponse
1. Repérer le réactif et les produits.
Positionner les espèces chimiques de part et d'autre de l'équation‑bilan.
Ajuster les coefficients stœchiométriques.
2. Calculer la masse molaire du saccharose.
Déterminer la quantité de saccharose à partir de la masse contenue dans la canette.
En déduire la concentration finale à partir du volume de la canette.
3. Repérer les valeurs minimale et maximale pour le temps t et la concentration en fructose [\text{C}_6\text{H}_{12}\text{O}_6].
Tracer les axes gradués pour un dimensionnement adapté.
Placer les points de mesure.
4. À partir de la quantité de fructose finale, déterminer la quantité de fructose à t_{1/2}.
En déduire graphiquement t_{1/2}.
5. Commenter la valeur par rapport au temps de vie du soda et de la canette.
Positionner les espèces chimiques de part et d'autre de l'équation‑bilan.
Ajuster les coefficients stœchiométriques.
2. Calculer la masse molaire du saccharose.
Déterminer la quantité de saccharose à partir de la masse contenue dans la canette.
En déduire la concentration finale à partir du volume de la canette.
3. Repérer les valeurs minimale et maximale pour le temps t et la concentration en fructose [\text{C}_6\text{H}_{12}\text{O}_6].
Tracer les axes gradués pour un dimensionnement adapté.
Placer les points de mesure.
4. À partir de la quantité de fructose finale, déterminer la quantité de fructose à t_{1/2}.
En déduire graphiquement t_{1/2}.
5. Commenter la valeur par rapport au temps de vie du soda et de la canette.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Solution rédigée
1. L'équation-bilan est :
2. La masse molaire du saccharose est égale à M = 342 g·mol-1. La quantité initiale de saccharose est :
AN : n = \dfrac{35}{342} = 0{,}10 mol
D'après les coefficients stœchiométriques, il se sera formé 0,10 mol de fructose, soit :
AN : c = \dfrac{0{,}10}{330 \times 10^{-3}} = 0{,}30 mol·L-1
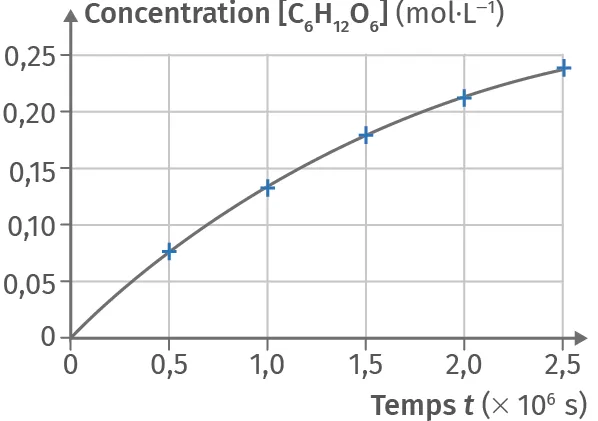
3. Le graphique est représenté sur le ci-contre.
4. D'après le graphique, le temps de demi-réaction, pour une concentration de 0,15 mol·L-1, est égal à t_{1/2} = 1,2 \times 10^6 s.
5. Au bout de t_{1/2} = 14 j, la moitié du saccharose s'est hydrolysée. Cette durée est relativement courte comparée à la durée de conservation d'un soda.
\text{C}_{12}\text{H}_{22}\text{O}_{11}(\text{aq}) + \text{H}_2\text{O}(\text{l}) \rightarrow \ \underbrace{\text{C}_6\text{H}_{12}\text{0}_6(\text{aq})}_{\text{fructose}} + \underbrace{\text{C}_6\text{H}_{12}\text{0}_6(\text{aq})}_{\text{glucose}}
2. La masse molaire du saccharose est égale à M = 342 g·mol-1. La quantité initiale de saccharose est :
-
n = \dfrac{m}{M}
AN : n = \dfrac{35}{342} = 0{,}10 mol
D'après les coefficients stœchiométriques, il se sera formé 0,10 mol de fructose, soit :
-
c = \dfrac{n}{v}
AN : c = \dfrac{0{,}10}{330 \times 10^{-3}} = 0{,}30 mol·L-1
3. Le graphique est représenté sur le ci-contre.
4. D'après le graphique, le temps de demi-réaction, pour une concentration de 0,15 mol·L-1, est égal à t_{1/2} = 1,2 \times 10^6 s.
5. Au bout de t_{1/2} = 14 j, la moitié du saccharose s'est hydrolysée. Cette durée est relativement courte comparée à la durée de conservation d'un soda.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. Fructose dans la canette

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Mise en application
Découvrez l', Décomposition du peroxyde d'hydrogène pour travailler cette notion.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

