Chapitre 10
Cours
Stratégies de synthèse
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Modifications en synthèse organique
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AAddition, élimination ou substitution ?
On distingue trois types de réactions chimiques : l'addition, la substitution et l'élimination.
Une réaction de substitution est une réaction au cours de laquelle un atome ou groupe d'atomes, lié à un carbone par une liaison simple, est remplacé par un autre atome ou groupe d'atomes :

Une réaction d'addition est un ajout d'atomes ou de groupes d'atomes sur une molécule possédant au moins une liaison multiple (double ou triple) :

Une réaction d'élimination est un retrait d'atomes ou de groupes d'atomes sur une molécule conduisant à la formation d'une liaison multiple (double ou triple) :

Ces réactions conduisent à une modification du groupe caractéristique et/ou à une modification de la chaîne carbonée.

Une réaction d'addition est un ajout d'atomes ou de groupes d'atomes sur une molécule possédant au moins une liaison multiple (double ou triple) :

Une réaction d'élimination est un retrait d'atomes ou de groupes d'atomes sur une molécule conduisant à la formation d'une liaison multiple (double ou triple) :

Ces réactions conduisent à une modification du groupe caractéristique et/ou à une modification de la chaîne carbonée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BModification du groupe caractéristique
Lors d'une étape de synthèse organique, il peut y avoir modification du groupe caractéristique.
Dans ce cas, le produit obtenu appartient à une famille fonctionnelle
différente de celle du réactif initial.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CModification de la chaîne carbonée
Lors d'une étape de la synthèse organique, il peut y avoir modification de la chaîne carbonée avec :
- raccourcissement de la chaîne carbonée ;
- allongement de la chaîne carbonée ;
- réarrangement.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Même si on parle de réactions d'addition, de substitution et d'élimination en chimie organique, des réactions acide-base ou d'oxydoréduction peuvent aussi avoir lieu. Elles ne sont pas spécifiques à la chimie organique puisqu'elles se produisent aussi en chimie des solutions aqueuses.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Groupe caractéristique et famille fonctionnelle
Monomère
Polymère
Groupe caractéristique et famille fonctionnelle : lorsque des atomes différents des atomes hydrogène et de carbone sont liés aux atomes de carbone d'une molécule organique, ils constituent un groupe caractéristique à l'origine de la réactivité de la molécule.
Chaque groupe caractéristique permet de définir une famille de composés chimiques.
Monomère : molécule susceptible de se combiner avec d'autres molécules de même formule ou de formule différente pour constituer un polymère.
Polymère : toute molécule dont la structure présente la répétition d'un même motif correspondant à un enchaînement de monomères.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Familles fonctionnelles courantes
| Famille fonctionnelle | Groupe caractéristique |
|---|---|
| Alcool |
 |
| Cétone |
 |
| Aldéhyde |
 |
| Acide carboxylique |
 |
| Ester |
 |
| Amine |
 |
| Amide |
 |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Au cours d'une synthèse en chimie organique, il y a souvent une modification simultanée de groupe caractéristique et de chaîne carbonée. Ces deux modifications ne doivent pas être opposées l'une à l'autre.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
DPolymérisation
Les monomères produisent des polymères lors de réactions de polymérisation. On distingue deux types de réactions de polymérisation : la polyaddition et la polycondensation.
Exemple :

Exemple :

La polyaddition concerne les monomères possédant une double liaison \text{C = C}. Les monomères s'additionnent les uns aux autres grâce à la présence de cette double liaison.
Exemple :

La polycondensation consiste en la synthèse de polymère lors de laquelle il y a libération de petites molécules, généralement de l'eau \text{H}_\text{2}\text{O} ou du chlorure d'hydrogène \text{HCl}.
Exemple :

Les réactions de polymérisation sont des exemples de réactions chimiques au cours desquelles il peut y avoir modification de la chaîne carbonée et/ou du groupe caractéristique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Synthèse d'un polymère

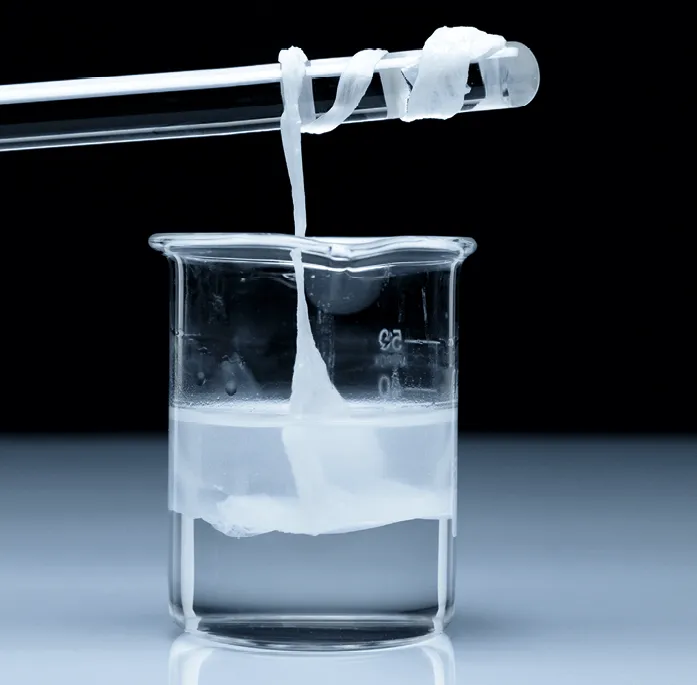
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3Exemples de molécules polyfonctionnelles
- 3‑méthylhex‑4‑en‑1‑ol
- para‑aminophénol


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Retrouvez une explication des transformations en chimie organique en vidéo :
Matthieu Colombel,
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Protection et déprotection
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AComposés polyfonctionnels
Un composé est dit polyfonctionnel s'il possède plusieurs groupes caractéristiques.
En synthèse organique, les composés polyfonctionnels sont souvent utilisés.
Lors d'une réaction chimique mettant en jeu des composés polyfonctionnels, les groupes caractéristiques de ces molécules
sont susceptibles de réagir.
Il peut s'avérer nécessaire, dans certains cas, de protéger un groupe caractéristique pour l'empêcher de réagir.
Il peut s'avérer nécessaire, dans certains cas, de protéger un groupe caractéristique pour l'empêcher de réagir.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 4Exemple de polymère


Des granulés de polymère, utilisés dans la fabrication du plastique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BPrincipe de la protection
La protection d'un groupe caractéristique consiste à transformer temporairement ce groupe en un autre groupe ne réagissant pas, appelé groupe protecteur.
- réagir sélectivement avec la fonction à protéger ;
- être stable lors des réactions suivantes ;
- pouvoir être enlevé facilement une fois la réaction terminée ;
- être tel que les étapes de protection et de déprotection aient un très bon rendement.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Lorsque deux acides aminés sont mis en présence, deux réactions sont possibles entre les deux différents acides aminés, mais il peut aussi y avoir des réactions entre acides aminés identiques. Cela conduit à quatre dipeptides qui peuvent donc se former.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Liaison peptidique
Liaison peptidique : liaison formée entre deux acides aminés. Il s'agit d'un groupe amide issue de la réaction entre le groupe carboxyle d'un des deux acides aminés et le groupe amine de l'autre.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CExemple autour de la liaison peptidique


Ainsi, la seule réaction possible est :

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Certains composés polyfonctionnels peuvent réagir de façon sélective : on dit alors que la réaction est chimiosélective. Il n'y a pas besoin dans ce cas de protéger et de déprotéger les autres groupes caractéristiques de la molécule.
C'est le cas lors de la synthèse du paracétamol à partir du para-aminophénol : seule la fonction amine réagit avec l'anhydride éthanoïque :

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 5Déprotection
Pour finir cette synthèse, les deux groupes protecteurs sont ensuite enlevés et le produit final est récupéré
(déprotection). Dans le cas présenté, celle-ci conduit donc au produit final suivant :


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3Synthèses écoresponsables
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Depuis la Seconde Guerre mondiale, l'industrie chimique s'est considérablement développée et les produits issus de cette industrie sont omniprésents dans notre quotidien.

Voici une liste non exhaustive de pratiques permettant de mettre en œuvre les principes de la chimie verte :
Cependant, lors de cette expansion rapide, l'industrie chimique n'a pas toujours eu conscience des conséquences à moyen et long termes de certaines pratiques. La prise de conscience, dans les années 1970, a conduit à un changement important. Cette réforme a abouti dans les années 1990 au concept de « chimie verte » :

Voici une liste non exhaustive de pratiques permettant de mettre en œuvre les principes de la chimie verte :
- l'économie d'atomes privilégiant les réactions d'addition ou de réarrangement plutôt que les réactions de substitution et d'élimination, peu économes en atomes ;
- la catalyse pour réduire la consommation énergétique, diminuer la quantité de réactifs utilisés et diminuer les étapes de séparation ;
- les conditions de réactions alternatives comme l'usage des micro‑ondes ou encore des ultrasons ;
- les solvants verts comme le dioxyde de carbone supercritique comme solvant apolaire ou l'eau en tant que solvant polaire ;
- la valorisation des agro-ressources avec l'exploitation des ressources végétales ou la substitution des matières premières pétrochimiques par la biomasse végétale ;
- la valorisation du dioxyde de carbone comme solvant ou comme réactif.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Chimie verte (ou chimie durable)
Synthèse écoresponsable
Chimie verte (ou chimie durable) : chimie qui s'appuie sur la mise en œuvre de douze principes pour réduire et éliminer l'usage ou la génération de substances néfastes pour l'environnement.
Synthèse écoresponsable : synthèse « propre », c'est-à-dire respectueuse de l'environnement.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- L'économie d'atomes \bm{EA}(ou utilisation atomique UA) est utilisée comme indicateur de l'efficacité d'un procédé.
EA=\frac{\sum_\text{i} \text{a}_\text{i} \cdot M_\text{i}}{\sum_\text{j} \text{b}_\text{j} \cdot M_\text{j}}
EA : économie d'atomes
\text{a}_\text{i} : coefficients stœchiométriques des produits désirés
M_\text{i} : masses molaires des produits désirés (g⋅mol-1)
\text{b}_\text{j} : coefficients stœchiométriques des réactifs
M_\text{j} : masses molaires des réactifs (g⋅mol-1)
\text{a}_\text{i} : coefficients stœchiométriques des produits désirés
M_\text{i} : masses molaires des produits désirés (g⋅mol-1)
\text{b}_\text{j} : coefficients stœchiométriques des réactifs
M_\text{j} : masses molaires des réactifs (g⋅mol-1)
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 6Biomasse


La biomasse désigne toute la matière d'origine végétale utilisée comme source d'énergie ou de molécules organiques.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour aller plus loin, retrouvez plus d'informations sur
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

